Analyse mariner Zucker
Warum analysieren wir Zucker in der Meeresforschung?
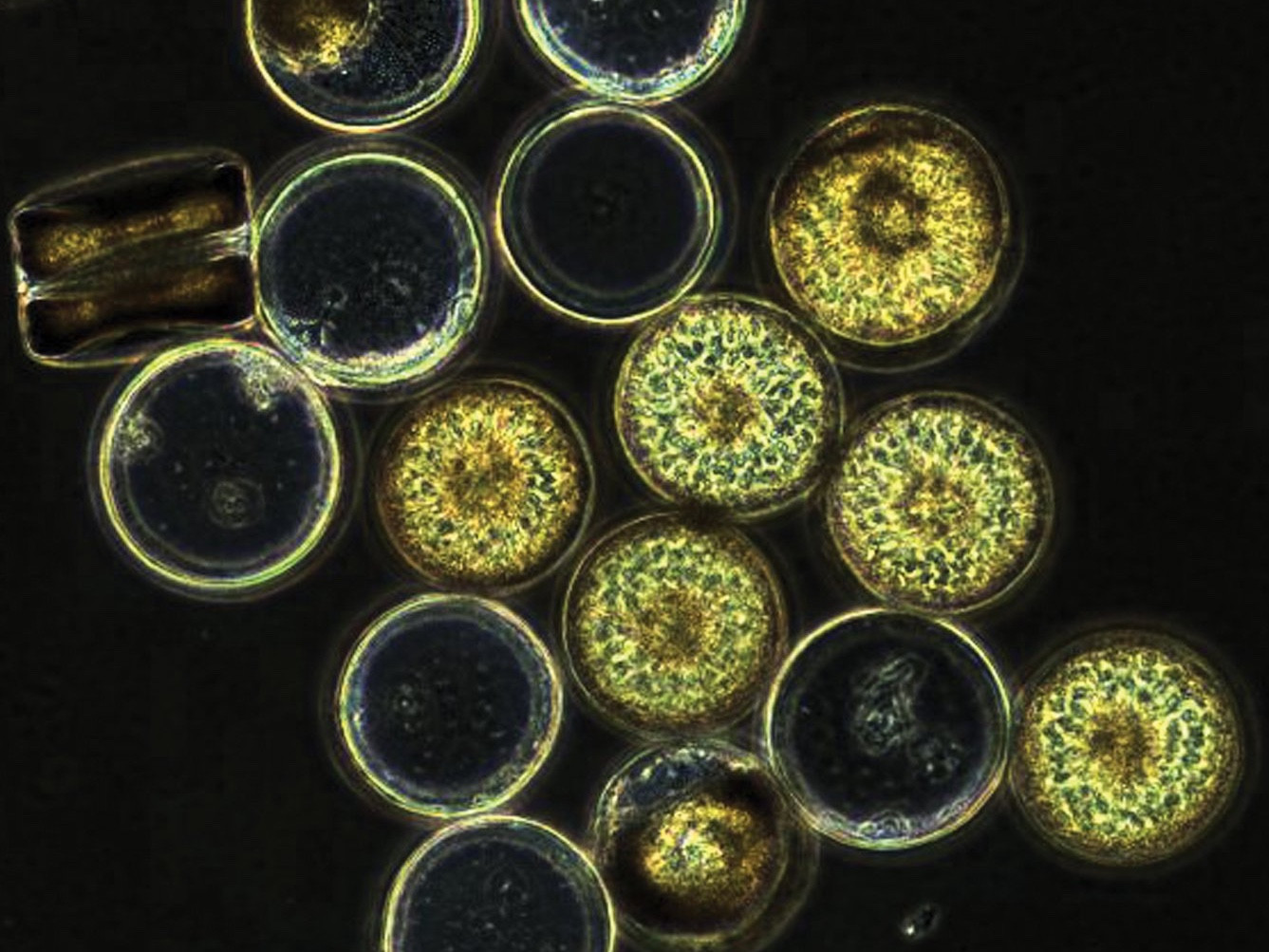
Ein wichtiger Weg zur Kohlenstoffbindung im Ozean ist das Wachstum, die Ansammlung und das Absinken des Phytoplanktons – einzelliger Mikroalgen, wie Kieselalgen. So wie Pflanzen an Land bindet das Phytoplankton den Kohlenstoff aus dem Kohlendioxid der Atmosphäre. Wenn sich viele Algenzellen ansammeln, werden sie schwer, beginnen zu sinken und nehmen den Kohlenstoff mit zum Ozeanboden. Diese so genannte biologische Kohlenstoffpumpe macht etwa 70 Prozent des jährlichen globalen Kohlenstoff-Transports in die Tiefsee aus. Schätzungsweise 25 bis 40 Prozent des Kohlendioxids, das aus dem Verbrennen fossiler Brennstoffe durch den Menschen stammt, könnte durch diesen Prozess aus der Atmosphäre in Tiefen unter 1000 Meter transportiert worden sein. Dort kann Kohlenstoff für bis zu vier Jahrtausende gespeichert werden.
Doch wie der Prozess der Kohlenstoffpumpe auf molekularer Ebene funktioniert, ist bislang nur wenig verstanden – obwohl er so wichtig ist. Die Wissenschaftlerinnen und Wissenschaftler der Forschungsgruppe Marine Glykobiologie des Max-Planck-Instituts für Marine Mikrobiologie und des MARUM – Zentrum für Marine Umweltwissenschaften der Universität Bremen untersuchen in dem Zusammenhang marine Polysaccharide, also Mehrfachzuckerverbindungen, die von Algen gebildet werden. Mikroalgen im Meer produzieren jede Menge Zucker während der Algenblüten. Normalerweise werden diese enormen Mengen an Biomasse sehr schnell durch marine Bakterien recycelt. Besonders Zucker galt lange als leckere, leicht verdauliche Speise für hungrige Mikroben und deshalb als wenig geeignet für die natürliche Speicherung von Kohlenstoff. Doch neue Forschungsergebnisse zeigen: Es gibt mindestens einen Zucker in Algen, der dem mikrobiellen Abbau widersteht.
Solche Polysaccharide könnten – so die Hypothese, die im Fokus der Forschungsgruppe steht – im Ozean dafür verantwortlich sein, dass kohlenstoffreiches Material schneller befördert wird, analog zur Nahrung beim Menschen. Auch in unserem Körper tragen Mehrfachzucker dazu bei, dass Nahrung schneller verdaut wird. Bezogen auf den Ozean könnten diese resistenten Zucker dabei helfen, Kohlenstoff in der Tiefe des Meeres und im Sediment zu speichern.
Wie funktioniert die Analyse von Algenzuckern?
Diese marinen Zucker sind strukturell sehr unterschiedliche Verbindungen und gehören zu den komplexesten Biomolekülen, die in der Natur zu finden sind. Ein einzelnes Bakterium ist nicht in der Lage, die Zucker-Mischung allein zu verwerten. Hierfür ist ein ganzes Ensemble an Abbauwegen und Enzymen notwendig. In der Natur bewerkstelligt dies eine Gemeinschaft verschiedener Bakterien, die eng und sehr effizient zusammenarbeiten – ein perfekt eingespieltes Team.
Um mikrobiell resistente Zucker zu finden, haben sich die Bremer Wissenschaftlerinnen und Wissenschaftler einen kompetenten Lehrmeister gesucht: Die zuckerabbauenden Bakterien. Diese Bakterien haben nämlich Wege gefunden, um Mehrfachzucker aufzuspüren und als Nahrung zu verwenden. Sie nutzen Proteine, um die Zucker einzufangen und Enzyme, um sie zu verdauen. Jedes Bakterium hat dabei eigene Enzyme, seine eigenen Werkzeuge, um Polysaccharide in kleinere, einfachere Einheiten zu zerschneiden. Diesen Mechanismus untersucht die Forschungsgruppe, denn diese Einfachzucker sind leichter zu messen als Polysaccharide.
So können durch die Messung der Einfachzucker, ähnlich einem Diabetes-Zuckertest, auch die Mehrfachzucker quantifiziert werden. Dank dieses Verfahrens ist es nun möglich zu messen, welche Zucker am häufigsten vorkommen, welche in die Tiefe sinken und somit als Ballaststoff im Ozean wirken. Dies wiederum lässt Rückschlüsse auf die Rolle der Polysaccharide im Kohlenstoffkreislauf zu.
Welche Geräte werden dafür benötigt?
Da es sich um komplexe Verfahren handelt, werden unterschiedliche Geräte und Techniken verwendet. Hier stellen wir die Wichtigsten vor.
Algenzucht
Für die Analyse der Zucker von Mikroalgen gibt es regelmäßige Probenahmen während der Frühjahrsalgenblüte vor Helgoland. Gleichzeitig züchten wir Mikroalgen aber auch im Institut, um herauszufinden welche Algenart welche Mehrfachzucker produziert.
Hochleistungs-Flüssigchromatographie
Eine wichtige Rolle bei der Analyse der Algenzucker spielt die HPLC. Diese Abkürzung steht für High Performance Liquid Chromatography, auf Deutsch Hochleistungs-Flüssigchromatographie. Dabei handelt es sich um ein Trennverfahren, bei dem ein Stoffgemisch mit Hilfe von zwei Phasen aufgetrennt wird. In der Flüssigchromatographie ist die stationäre Phase ein Feststoff, die mobile, zu trennende Phase eine Flüssigkeit. Das Prinzip dieser Analyseform bzw. Trennung wird hier erläutert. In der Zuckeranalyse werden zunächst Enzyme oder Salzsäure verwendet, um die marinen Mehrfachzucker in kleine Fragmente zu zerbrechen. Diese Fragmente können anschließend anhand ihrer Größe und Struktur in der HPLC aufgetrennt und mit entsprechenden Standards identifiziert werden.
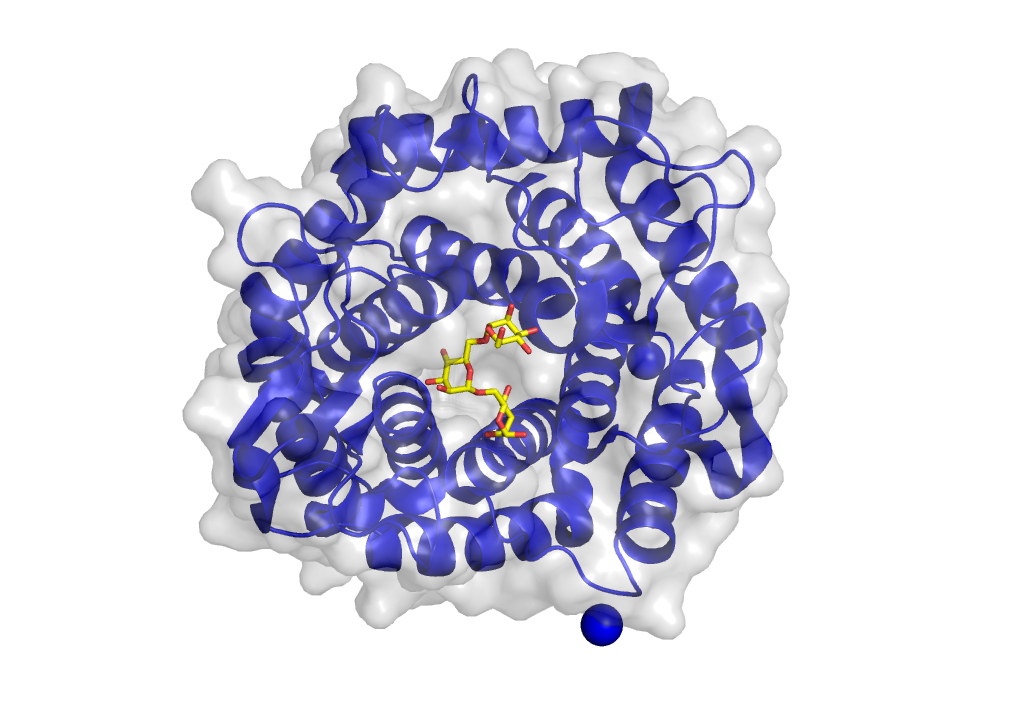
Die eigentlichen Werkzeuge in diesem Verfahren sind die Enzyme der zuckerfressenden Bakterien. Diese Enzyme werden in gentechnisch-veränderten Bakterien in großen Mengen produziert. Sobald die genaue Funktionsweise der Enzyme durch Enzymassays und Röntgenstrukturanalyse (siehe unten) bekannt ist, können diese Werkzeuge eingesetzt werden, um die Algenzucker in kleinere, einfacher zu analysierende Bausteine – die Monosaccharide (Einfachzucker) zu zerlegen. Die Enzyme erlauben es (im Gegensatz zur Salzsäure) ganz spezifische Fragmente zu erzeugen. Mit dieser Vorgehensweise kann sowohl festgestellt werden wie die einzelne Bausteine verknüpft sind (da Enzyme meist nur bestimmte Verbindungen erkennen und spalten können) als auch in welchen Mengenverhältnissen die unterschiedlichen Monosacharide in der Originalprobe vorhanden sind.
Micro-Array
Angewendet wird auch eine Methode, die ursprünglich aus der Medizin- und der Pflanzenforschung stammt. Sie kombiniert die hohe Durchsatzkapazität von Microarrays mit der Genauigkeit von monoklonalen Antikörpern. Das bedeutet, dass die Wissenschaftlerinnen und Wissenschaftler die Zuckermoleküle aus den Meerwasserproben zunächst extrahieren und anschließend in eine Maschine einsetzen, die wie ein Drucker funktioniert. Nur, dass dieser "Drucker" keine Tinte, sondern die Mehrfachzucker auf Nitrocellulosepapier "druckt", den Microarray. Ein Microarray ähnelt einem Mikrochip; klein wie ein Fingernagel kann er Hunderte von Proben enthalten. Sind die unterschiedlichen Zuckermoleküle auf den Mikroarray aufgetragen, können die enthaltenen Zucker mit monoklonalen Antikörpern analysiert werden. Einzelne Antikörper werden dafür zu den Zuckermolekülen auf dem Array gegeben und da sie jeweils mit nur einem spezifischen Zucker reagieren, können die Forschenden sehen, welche Zucker in der Probe enthalten sind.





Röntgenstrukturanalyse
Die in großen Mengen produzierten Enzyme werden aus den Bakterien über mehrere Flüssigchromatographie-verfahren (IEX, IMAC) extrahiert, bis nur noch minimale Mengen anderer Enzyme und Salze vorhanden sind. Anschließend werden die Enzyme mit kristallbildenden Flüssigkeiten versetzt. Diese entziehen den Enzymen langsam Wasser und zwingen sie so in eine kristalline Form. Im Anschluss werden die gebildeten Kristalle aus der Flüssigkeit gefischt. Diese werden mit flüssigen Stickstoff schockgefroren und anschließend an ein Partnerlabor verschickt, in dem die Kristalle mit Röntgenstrahlen bestrahlt werden. Durch diese Methode können die Wissenschaftlerinnen und Wissenschaftler in das Innere der Enzyme blicken und Erkenntnisse über die Struktur- und Funktionsweisen der Enzyme gewinnen.
Damit können nicht nur Enzyme gefunden werden, welche die Polysaccharide zerschneiden, sondern auch welche, die diese Polysaccharide nur binden und festhalten und ähnlich wie Antikörper funktionieren.
Beispielprojekte
Süße Algenpartikel widerstehen hungrigen Bakterien
Eher süß als salzig: Mikroalgen im Meer produzieren jede Menge Zucker während der Algenblüten. Diese enormen Mengen an Biomasse werden normalerweise durch marine Bakterien sehr schnell recycelt – ein Abbauprozess, der einen wichtigen Teil des globalen Kohlenstoffkreislaufs ausmacht. Besonders Zucker galt lange als leckere, leicht verdauliche Speise für hungrige Mikroben und deshalb als wenig geeignet für die natürliche Speicherung von Kohlenstoff. Forschende aus Bremen haben aber nun entdeckt: Es gibt einen Zucker in Algen, der dem mikrobiellen Abbau widersteht und so deutlich mehr Kohlenstoff in die Tiefsee transportieren könnte als bisher angenommen. Diese Erkenntnisse wurden jetzt im wissenschaftlichen Magazin Nature Communications veröffentlicht.
Mehr Informationen zu dem Thema gibt es in der Pressemitteilung "Süße Algenpartikel widerstehen hungrigen Bakterien"
Die Originalveröffentlichung:
Silvia Vidal-Melgosa, Andreas Sichert, T. Ben Francis, Daniel Bartosik, Jutta Niggemann, Antje Wichels, William G.T. Willats, Bernhard M. Fuchs, Hanno Teeling, Dörte Becher, Thomas Schweder, Rudolf Amann, Jan-Hendrik Hehemann: Diatom fucan polysaccharide precipitates carbon during algal blooms. Nature Communications, Februar 2021

Zucker macht Braunalgen zu guten Kohlenstoffspeichern
Braunalgen speichern große Mengen an Kohlendioxid und entziehen das Treibhausgas so der Atmosphäre. Der mikrobielle Abbau abgestorbener Braunalgenreste und die damit verbundene Rückgabe dieses gespeicherten Kohlendioxids in die Atmosphäre dauert länger als bei anderen Meerespflanzen. Forschende des Max-Planck-Instituts für Marine Mikrobiologie, des MARUM – Zentrum für Marine Umweltwissenschaften der Universität Bremen und weiterer Institute haben sich den Abbau-Prozess genau angesehen und sind dabei auf hochspezialisierte Bakterien gestoßen, die über hundert Enzyme nutzen müssen, um die Algen kleinzukriegen.
Mehr Informationen zum Thema gibt es in der Pressemitteilung "Zucker macht Braunalgen zu guten Kohlenstoffspeichern"
Die Originalveröffentlichung:
Andreas Sichert#, Christopher H. Corzett#, Matthew S. Schechter, Frank Unfried, Stephanie Markert, Dörte Becher, Antonio Fernandez-Guerra, Manuel Liebeke, Thomas Schweder, Martin F. Polz, Jan-Hendrik Hehemann: Verrucomicrobia use hundreds of enzymes to digest the algal polysaccharide fucoidan. Nature Microbiology, Mai 2020.
DOI: 10.1038/s41564-020-0720-2
# Die beiden Autoren haben gleichberechtigt zum Paper beigetragen
Kontakt
Gruppenleiter
MARUM MPG Brückengruppe Marine Glykobiologie
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
2126 |
|
Telefon: |