- Presse
- Pressemeldungen 2020
- Zucker macht Braunalgen zu guten Kohlenstoffspeichern
Zucker macht Braunalgen zu guten Kohlenstoffspeichern
Man kann sie schön finden oder auch nicht, aber fast jeder kennt sie: die Braunalge Fucus vesiculosus, auch Blasentang genannt. Sie wächst fast überall entlang der deutschen Nord- und Ostseeküste. Andere Braunalgen wie Macrocystis bilden entweder ganze Wälder entlang der Pazifikküste oder so wie Sargassum Algenblüten, deren Aggregate den Atlantik von West nach Ost bedecken. Ein produktives Ökosystem, das manche Ökologinnen und Ökologen als marines Gegenstück zu den Regenwäldern an Land sehen. Durch Braunalgen werden hohe Mengen an Kohlendioxid gespeichert, dadurch sind sie ein wichtiger Teil des globalen Kohlenstoffkreislaufs.
Andreas Sichert vom Max-Planck-Institut für Marine Mikrobiologie widmete sich in seiner Doktorarbeit der Frage, warum Braunalgen ein so guter Kohlenstoffspeicher sind: „Hauptbestandteil der Algenbiomasse sind ihre dicken Zellwände – ein enges Netzwerk aus Eiweißen und langkettigen Zuckern. Wenn die Alge stirbt, wissen wir kaum, was mit dieser Biomasse im Meer eigentlich passiert, zum Beispiel welche Bestandteile schnell oder langsam abgebaut werden.“
Fest und flexibel
Braunalgen sind dabei an den rauen Lebensraum der Atlantikküsten angepasst. Die Gezeiten, Wind und Wellen fordern von den Bewohnern dieser Gegend besondere Fähigkeiten. So haben die Braunalgen eine spezielle Zellwandstruktur entwickelt. Diese ist gleichzeitig fest und flexibel und ermöglicht es der Pflanze, den Wellen und den Gezeitenströmungen erfolgreich standzuhalten. Ein wichtiger Bestandteil der Zellwände ist dabei der langkettige Zucker Fucoidan, der rund ein Viertel des Trockengewichts einer Braunalge ausmacht. Fucoidan kann vermutlich, ähnlich einem Gel, den Wassergehalt der Zellwand regulieren und die Braunalgen so bei Ebbe vor dem Austrocknen schützen.
Welche Rolle dieser Zucker Fucoidan im langwierigen Abbauprozess der Braunalgen spielt, untersuchte Andreas Sichert zusammen mit Wissenschaftlerinnen und Wissenschaftlern der Forschungsgruppe Marine Glykobiologie des Max-Planck-Instituts für Marine Mikrobiologie und des MARUM – Zentrum für Marine Umweltwissenschaften der Universität Bremen. Außerdem beteiligt waren Forschende des Massachusetts Institute of Technology, der Universität Greifswald und der Universität Wien. „Man wusste bereits, dass Fucoidan langsamer von mikrobiellen Gemeinschaften abgebaut wird als andere Algenzucker und daher als Kohlenstoffsenke wirken könnte“, sagt Andreas Sichert, einer der beiden Erstautoren der Studie, die jetzt im Fachmagazin Nature Microbiology erschienen ist. „In der Regel sind langkettige Zucker eine beliebte Nahrung für Bakterien, aber warum gerade Fucoidan besonders schwer verdaulich ist, war unklar.“
Nur Spezialisten verdauen diesen Zucker
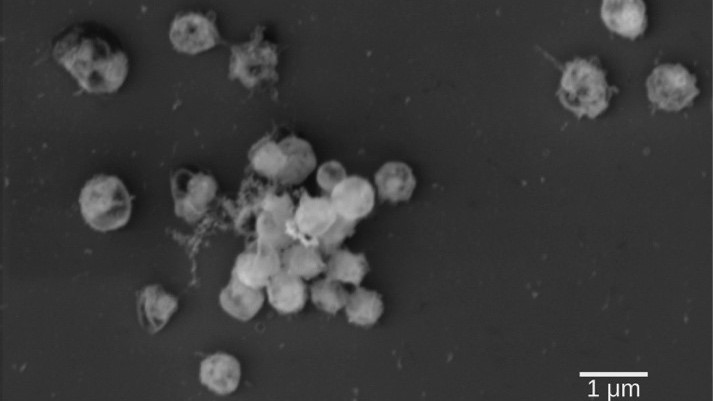
Bislang waren die Stoffwechselwege zum Abbau von Fucoidan nur teilweise bekannt, es gab aber Hinweise auf die Beteiligung einer hohen Anzahl von Enzymen, die entweder innerhalb einer mikrobiellen Gemeinschaft verteilt oder in einzelnen hochspezialisierten Bakterien untergebracht sind. Für die Untersuchung des Abbaus von Fucoidan verfolgten die Forschenden aus Bremen letztere Theorie und analysierten neu isolierte Bakterien der Gattung Lentimonas, die zum Stamm der Verrucomicrobia zählen. Allein die Isolation dieser Lentimonas Bakterien war nervenaufreibend. „Anfangs hatte ich über tausend Isolate, doch am Ende konnte nur eines Fucoidan wirklich abbauen“, erinnert sich Christopher H. Corzett vom Massachusetts Institute of Technology, neben Sichert Erstautor der Studie.
„Wir haben bei diesen Bakterien einen bemerkenswert komplexen Weg für den Abbau von Fucoidan entdeckt, bei dem etwa hundert Enzyme verwendet werden, um den Zucker Fucose freizusetzen – einen Bestandteil von Fucoidan“, sagt Jan-Hendrik Hehemann, Leiter der Forschungsgruppe Marine Glykobiologie. „Hierbei handelt es sich wahrscheinlich um einen der kompliziertesten bisher bekannten biochemischen Abbauwege für einen Naturstoff.“ Fucose wird anschließend über einen isolierten Bereich in den Bakterien abgebaut. Das von einer eiweißhaltigen Hülle umgebene Abteil schützt die Zelle vor dem toxischen Nebenprodukt Lactadehyd. „Die Notwendigkeit einer solch komplexen Zersetzung zeigt, dass Fucoidan für die meisten Meeresbakterien unverdaulich ist und nur durch hochspezialisierte Bakterien im Ozean effektiv abgebaut werden kann“, sagt Hehemann. „Das kann den langsamen Abbau von Braunalgen in der Umwelt erklären und lässt vermuten, dass Kohlenstoff im Ozean durch Fucoidan relativ lange gebunden wird.
Potenziell pharmakologisch wirksam
Wissenschaftlerinnen und Wissenschaftler sind auch deshalb an Enzymen für Fucoidan interessiert, weil es ein potenziell pharmakologisch wirksames Molekül ist, welches ähnliche Wirkung wie Heparin in der Blutgerinnung aufzeigt. „Enzyme, die spezifisch Fucoidan fragmentieren und somit helfen, dessen Strukturen aufzuklären, sind von großem wissenschaftlichem Interesse, um die Wirkung von Fucoidan besser zu verstehen und diese marinen Zucker für biotechnologische Anwendungen zu erschließen“, sagt der beteiligte Greifswalder Mikrobiologe Thomas Schweder.
Originalveröffentlichung
Andreas Sichert#, Christopher H. Corzett#, Matthew S. Schechter, Frank Unfried, Stephanie Markert, Dörte Becher, Antonio Fernandez-Guerra, Manuel Liebeke, Thomas Schweder, Martin F. Polz, Jan-Hendrik Hehemann: Verrucomicrobia use hundreds of enzymes to digest the algal polysaccharide fucoidan. Nature Microbiology, Mai 2020.
DOI: 10.1038/s41564-020-0720-2
# Die beiden Autoren haben gleichberechtigt zum Paper beigetragen
Förderung
Diese Studie wurde durch die DFG im Rahmen der Emmy Noether Gruppe „Resolve“ und der Forschungsgruppe FOR2406 „POMPU - Proteogenomics of marine Polysaccharide Utilization“ gefördert.
Beteiligte Institutionen
- Max-Planck-Institut für Marine Mikrobiologie, Bremen, Deutschland
- MARUM – Zentrum für Marine Umweltwissenschaften der Universität Bremen, Deutschland
- Department of Civil and Environmental Engineering, Massachusetts Institute of Technology, Cambridge, USA
- Universität Greifswald, Deutschland
- Universität Wien, Österreich
Rückfragen bitte an:
Gruppenleiter
MARUM MPG Brückengruppe Marine Glykobiologie
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
2126 |
|
Telefon: |

Ansprechpartner der Universität Greifswald:
Prof. Dr. Thomas Schweder
Pharmazeutische Biotechnologie
Institut für Pharmazie
Telefon: +49 3834 420 4212
E-Mail: [Bitte aktivieren Sie Javascript]