- Presse
- Pressemeldungen 2019
- Upcycling in Symbiose: Von „minderwertigen“ Substanzen zu Biomasse
Upcycling in Symbiose: Von „minderwertigen“ Substanzen zu Biomasse

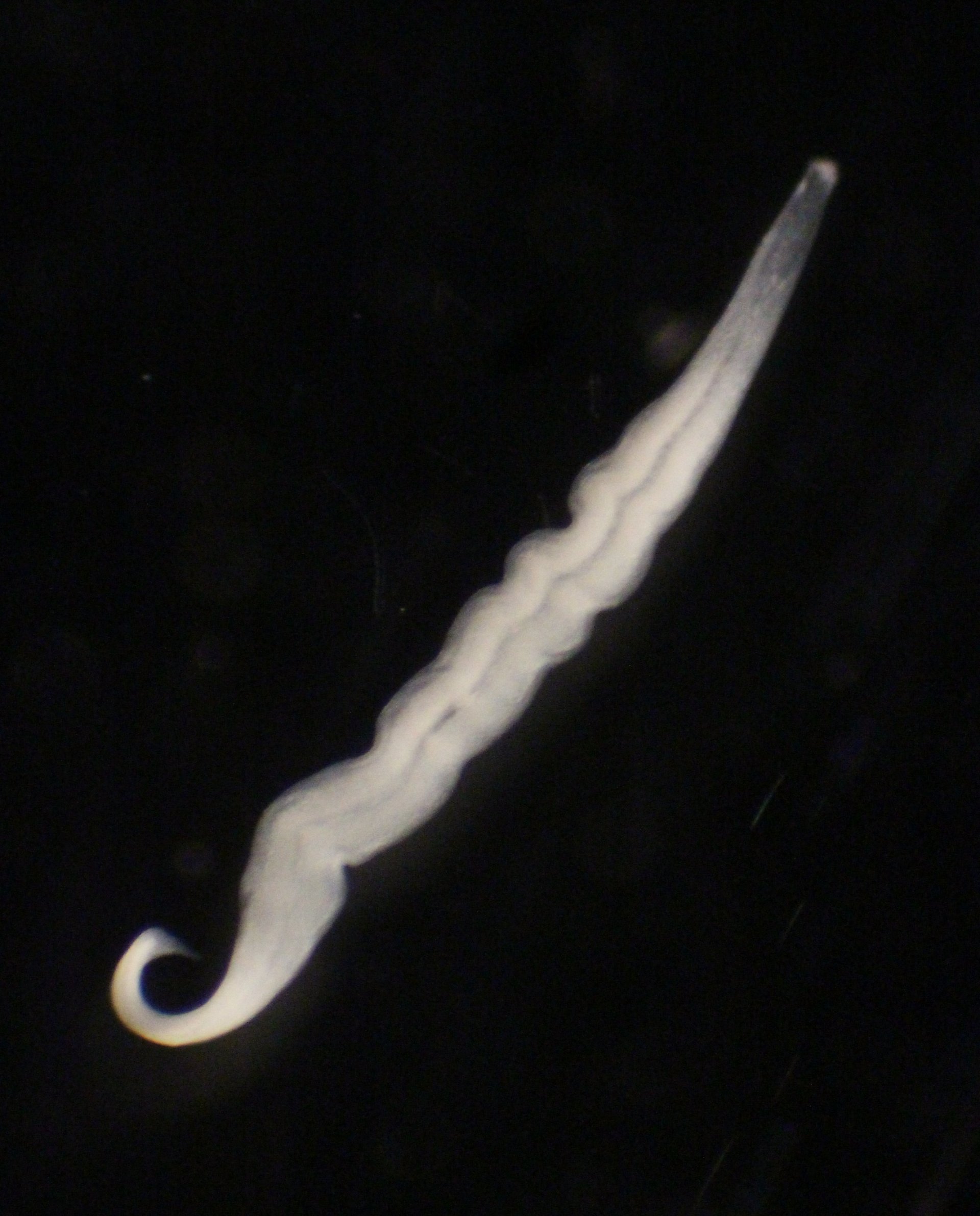
Pflanzen nutzen die Lichtenergie der Sonne, um mittels Photosynthese Kohlendioxid (CO2) in Biomasse umzuwandeln. Tiere sind dazu nicht in der Lage. Deshalb haben sich einige von ihnen mit Bakterien zusammengetan, die die sogenannte Chemosynthese beherrschen. Die funktioniert fast wie Photosynthese, nur dass chemische Energie anstelle von Lichtenergie genutzt wird.
Viele Tiere brauchen chemosynthetische Bakterien, die sie mit Nahrung versorgen. Diese Symbionten wandeln CO2 in Biomasse um und werden anschließend von ihrem Wirt verdaut. Kentron, ein Bakterium, das das Wimpertierchen Kentrophoros ernährt, galt bislang als "einfach noch so ein" chemosynthetischer Symbiont. Neue Ergebnisse deuten jedoch darauf hin, dass die Dinge anders liegen.
Aus Abfall wird Nahrung
Ein internationales ForscherInnenteam unter der Leitung des Max-Planck-Instituts für Marine Mikrobiologie sequenzierte das Genom von Kentron, dem schwefeloxidierenden Symbiont der Wimpertierchen (Ciliaten). „Entgegen unseren Erwartungen fanden wir keines der bekannten Gene, die für die Fixierung von CO2 erforderlich sind“, berichtet Erstautor Brandon Seah.
Wenn er kein CO2 binden kann, wovon lebt Kentron dann? „ Aus seinen Genen zu schließen, verwendet Kentron kleine organische Verbindungen und verwandelt diese in Biomasse“, erklärt Nicole Dubilier, Direktorin am Max-Planck-Institut für Marine Mikrobiologie und leitende Autorin der Studie. Dazu gehören Verbindungen wie Acetat oder Propionat – typische „minderwertige“ Abfallprodukte der Zellen. „So gesehen betreibt Kentron ein Upcycling, es wertet den Abfall auf. Kentron wandelt höchstwahrscheinlich Abfallprodukte aus der Umwelt und von ihren Wirten in höherwertige Biomasse um, um seinen Wirt zu ernähren.“
Isotopen-Fingerabdrücke bestätigen genetische Analysen
Kentrophoros ist ein dünnes, längliches Wimpertierchen, das in sandigen Meeresböden zuhause ist. Dort kann es leicht zwischen den Sandkörnchen hindurchgleiten. Bei der Ernährung ist es fast vollständig von seinen Symbionten abhängig, es hat nicht einmal mehr einen eigenen Mund. Seah, der mittlerweile am Max-Planck-Institut für Entwicklungsbiologie in Tübingen arbeitet, und seine KollegInnen sammelten Proben an Standorten im Mittelmeer, der Karibik und der Ostsee. Kentrophoros wächst und vermehrt sich aber nicht im Labor. Wie also konnten die ForscherInnen die Ernährungsgewohnheiten von Kentron untersuchen?
„Unsere Kollegen in Calgary und North Carolina haben eine Methode entwickelt, um sogar in unseren winzigen Proben den sogenannten Stabile-Isotopen-Fingerabdruck von Proteinen zu messen“, erklärt Seah. Dieser Fingerabdruck verrät einiges darüber, woher ein Organismus seinen Kohlenstoff bezieht. Der Fingerabdruck der Kentron-Bakterien ist ganz anders als jener von anderen chemosynthetischen Symbionten aus ähnlichen Lebensräumen. „Das zeigt deutlich, dass Kentron seinen Kohlenstoff anders bekommt als andere Symbionten.“
Lehrbuchwissen auf dem Prüfstand
Die vorliegenden Ergebnisse liefern ein Gegenbeispiel zur gängigen Lehrbuchmeinung. Diese besagt, dass symbiotische Bakterien den Großteil ihrer Biomasse aus CO2 oder Methan aufbauen. Im Gegensatz dazu scheint es Kentron nicht möglich zu sein, Biomasse so von Grund auf neu zu erzeugen. „Organische Substrate aus der Umwelt aufzunehmen und Abfälle ihrer Wirte zu recyclen könnte in diesen Symbiosen wichtiger sein, als bisher vermutet“, schließt Mitautor Harald Gruber-Vodicka vom Max-Planck-Institut für Marine Mikrobiologie. „Das ist bedeutsam fürn ökologische Modelle des Kohlenstoffkreislaufs in der Umwelt. Wir sind schon gespannt, demnächst die Details und Vor- und Nachteile der beiden Strategien genauer zu untersuchen."
Originalveröffentlichung:
Brandon K. B. Seah, Chakkiath Paul Anthony, Bruno Huettel, Jan Zarzycki, Lennart Schada von Borzyskowski, Tobias J. Erb, Angela Kouris, Manuel Kleiner, Manuel Liebeke, Nicole Dubilier, Harald R. Gruber-Vodicka: Sulfur-oxidizing symbionts without canonical genes for autotrophic CO2 fixation. mBio. DOI: 10.1128/mBio.01112-19
Beteiligte Institutionen:
- Max-Planck-Institut für Marine Mikrobiologie, 28359 Bremen
- Max Planck Genome Centre Cologne, Max-Planck-Institut für Pflanzenzüchtungsforschung, 50829 Köln
- Max-Planck-Institut für Terrestrische Mikrobiologie, 35043 Marburg
- Energy Bioengineering and Geomicrobiology Group, University of Calgary, Canada
- Department of Plant and Microbial Biology, North Carolina State University, USA
- MARUM Zentrum für Marine Umweltwissenschaften, Universität Bremen, 28359 Bremen
Rückfragen bitte an:
Dr. Brandon K. B. Seah
Max-Planck-Institut für Marine Mikrobiologie, Bremen, Deutschland
Aktuelle Adresse: Max-Planck-Institut für Entwicklungsbiologie, Tübingen Deutschland
Direktorin
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
3241 |
|
Telefon: |

Guest
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
2245 |
|
Telefon: |

Pressereferentin
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
1345 |
|
Telefon: |
