- Forschung & Instrumente
- Wie wir forschen - Unsere Instrumente und Methoden
- Instrumente und Methoden
- An Land
- Umwelt-Rasterelektronenmikroskop
Umwelt-Rasterelektronenmikroskop
Was ist ein Umwelt-Rasterelektronenmikroskop?
Bei der Untersuchung und Abbildung von sehr kleinen Objekten, wie zum Beispiel marinen Mikroorganismen, gelangt man sehr schnell an die Grenzen der optischen Mikroskopie. Um diese Organismen dennoch in ihrer Vielfalt abbilden zu können, ist die Anwendung der Rasterelektronenmikroskopie der nächste Schritt. In der Arbeitsgruppe Biogeochemie haben wir dafür ein Rasterelektronenmikroskop (REM), das mit verschiedenen Detektoren zur Bilderzeugung und Analysen ausgerüstet ist.
Wie funktioniert das Umwelt-Rasterelektronenmikroskop?
Ein REM ermöglicht eine höhere Auflösung (bis 1 nm bei 30 kV im Hochvakuum) und Schärfentiefe gegenüber einem lichtoptischen Mikroskop. Dabei wird durch eine Feldemissionskathode ein Elektronenstrahl erzeugt, der durch elektromagnetische Linsen auf die Probe fokussiert wird. Die Oberfläche der Probe wird punktweise von diesem Elektronenstrahl in einem Rechteck abgerastert. Es können dabei unterschiedliche Beschleunigungsspannungen (500 V bis 30 kV) für die Elektronen verwendet werden. Wenn der Elektronenstrahl (Primärelektronen, PE) auf die Oberfläche der Probe auftritt, kommt es zu verschiedenen Wechselwirkungen mit den Atomen der Probe und zur Entstehung von verschiedenen Signalen, unter anderem Sekundärelektronen, die zur Abbildung genutzt werden können.
Die Sekundärelektronen (SE) sind niedrigenergetische Elektronen und stammen auf Grund ihrer geringen Energie nur aus einer dünnen Schicht von der Oberfläche der Probe, und SE-Abbildungen beinhalten Informationen über den Topographiekontrast. Um sehr feine Strukturen bei sehr kleinen Mikroorganismen sehen zu können, ist eine schonende und dreidimensional-strukturerhaltende Probenvorbereitung mit der kritischen Punkt-Trocknung (CPD) notwendig. Dafür steht ein CPD-Gerät zur Verfügung.
Ein weiteres Signal, die Rückstreuelektronen („back scattered electrons“ BSE), sind höherenergetisch als die SE. BSE-Bilder enthalten Informationen über die Zusammensetzung der Probe durch den Materialkontrast. Bereiche mit Elementen mit höherer Kernladungszahl werden heller auf dem Bild dargestellt als Elemente mit niedriger Kernladungszahl.

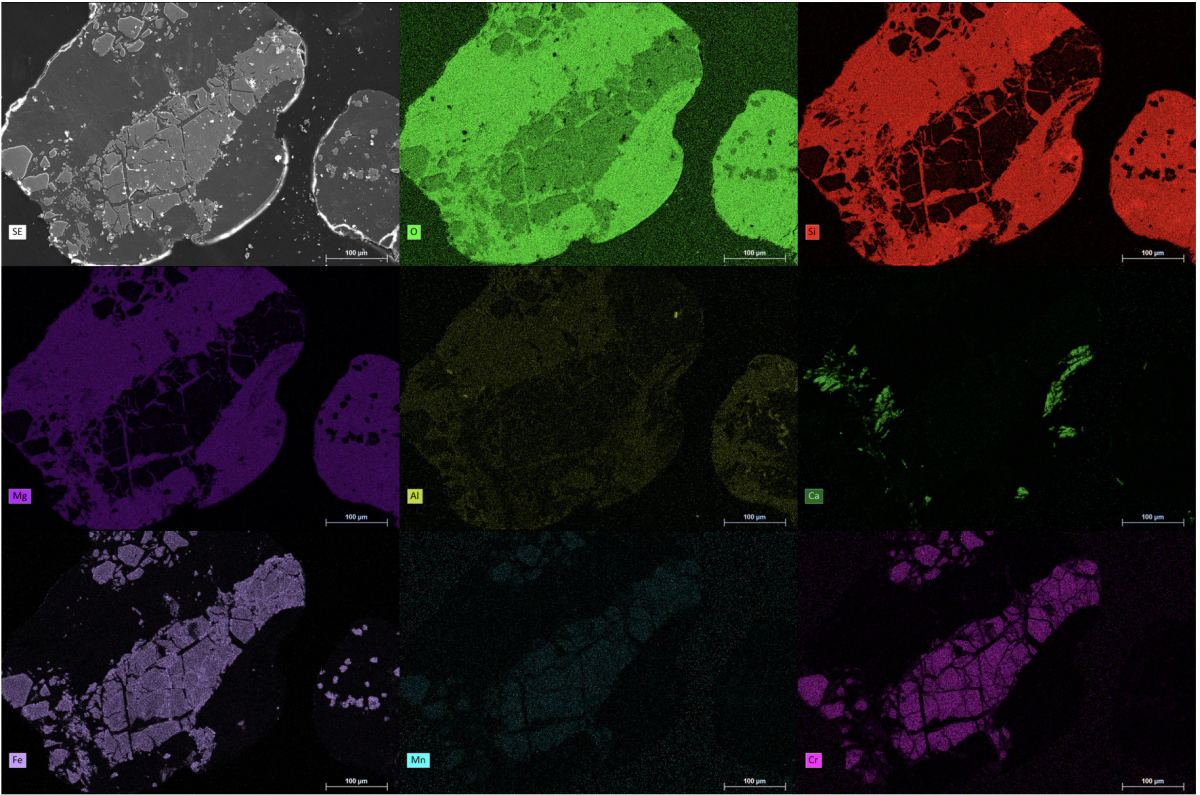
Das Rasterelektronenmikroskop ist mit unterschiedlichen Detektoren ausgerüstet, um SE und BSE in allen Vakuumarbeitsbereichen detektieren zu können. Entsprechend der Beschaffenheit der Probe können Untersuchungen im Hochvakuumbereich (6 x 10-4 Pa), Niedrigvakuum (10-130 Pa) und im ESEM-Modus (für Flüssigkeiten 10-4000 Pa) durchgeführt werden.
Ein weiteres Signal, das durch die Interaktion von den PE mit den Atomen der Probe entsteht, ist die charakteristische Röntgenstrahlung. Diese kann für die chemische Analyse einer Probe genutzt werden, da diese Röntgenstrahlung für jedes chemische Element charakteristisch ist und zur Identifizierung genutzt werden kann. Für die Detektion der charakteristischen Röntgenstrahlung ist unser REM mit einen Doppeldetektor-System der Firma Bruker Nano Analytics für die energiedispersive Röntgenspektroskopie (EDS oder EDX) ausgerüstet. Das EDS-System hat zwei Xflash 6/30-Detektoren (30 mm2 Detektorfläche) mit einer Energieauflösung <123 eV bei der Mangan Kα-Spektrallinie. Die Datenauswertung erfolgt mit Hilfe der Bruker Esprit 2.1 Software. Es können sowohl Punktanalysen als auch Element-Mapping mit diesem System durchgeführt werden.
Das REM kann auch für Rastertransmissionselektronenmikroskopie (STEM) genutzt werden. Dabei erfolgt die Abbildung und Analyse der Probe mittels transmittierter Elektronen. Es können mit dieser Methode Proben (Dünnschnitte) bis zu einer Dicke von 100 nm untersucht werden. Dafür wird ein spezieller Detektor (STEM Detektor) unterhalb der Probe platziert. Es werden meistens Beschleunigungsspannungen zwischen 20 und 30 kV genutzt.
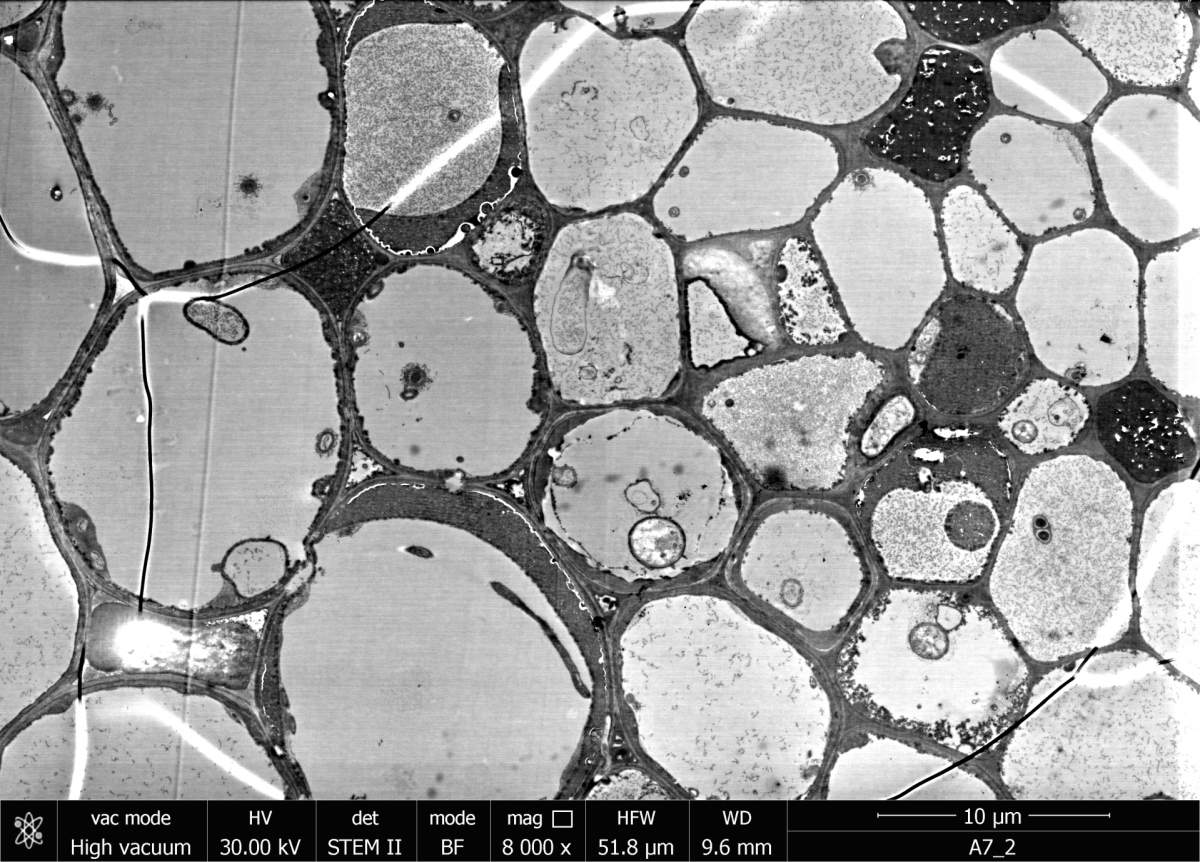
Das REM in der Abteilung Biogeochemie des MPI in Bremen kann zusätzlich auch mit einer SECOM-Plattform ausgerüstet werden. Die SECOM ermöglicht ein korrelatives Abbilden einer Probe mittels Rasterelektronen- und Fluoreszenzmikroskopie. Dafür muß die Probe auf einem Indium-Zinn-Oxid (ITO) beschichteten Glasträger vorbereitet werden. Dabei erfolgt die Rasterelektronenmikroskopie auf der leitfähigen Oberseite (ITO) des Glasträgers und die Fluoreszenzmikroskopie von der Unterseite durch den Glasträger hindurch. Dadurch ist es möglich bestimmte Mikroorganismen durch Fluoreszenz zu identifizieren und Oberflächenstrukturen mittels REM zu beschreiben.

Das Umwelt-Rasterelektronenmikroskop im Einsatz
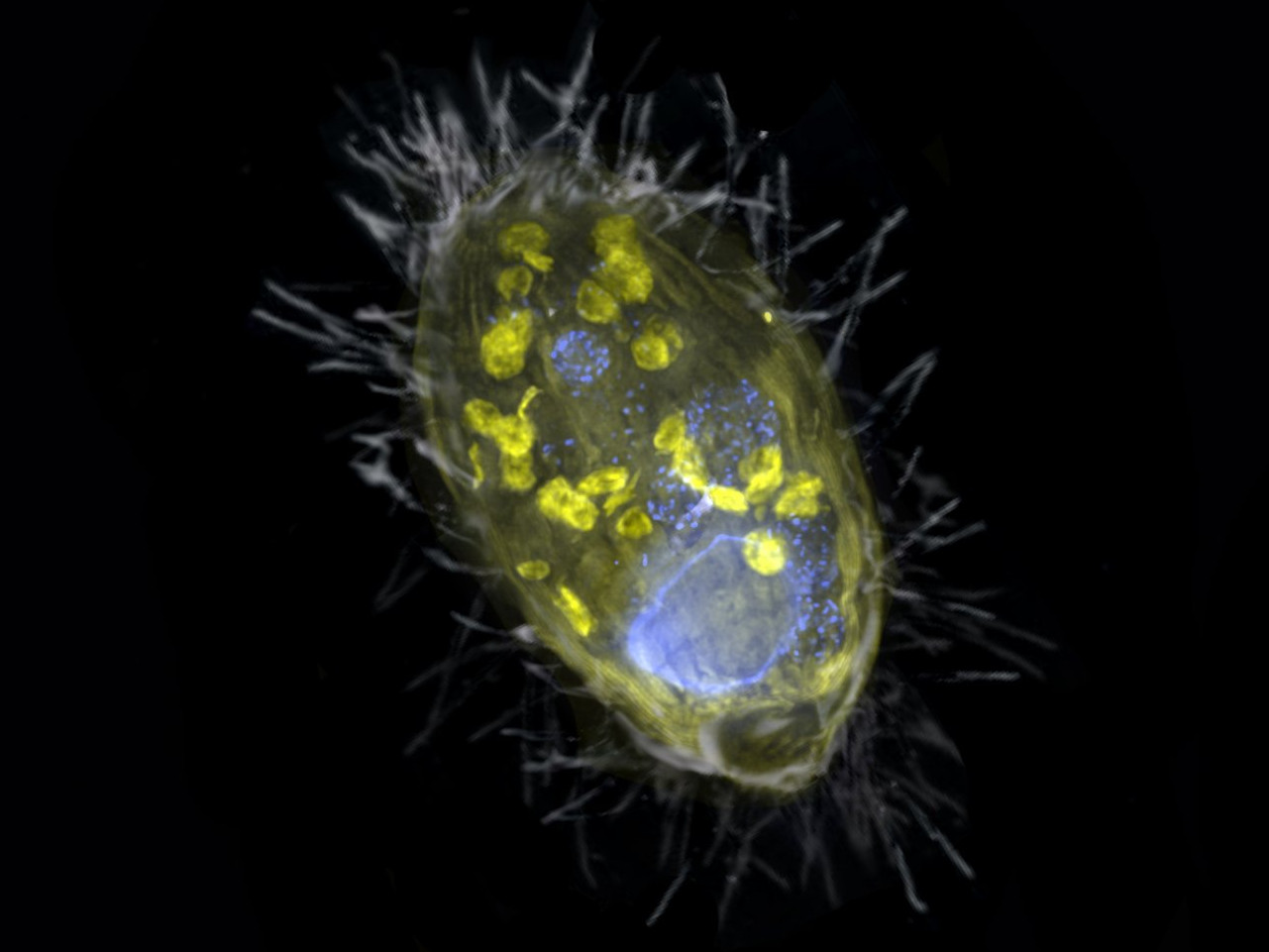
Neue Form der Symbiose entdeckt
Sie werden auch Kraftwerke der Zellen genannt: Die Mitochondrien. Sie kommen in fast allen Zellen mit einem Zellkern vor und versorgen sie mit Energie. Bisher war man davon ausgegangen, dass nur Mitochondrien die Aufgabe des Energielieferanten übernehmen können. Wissenschaftlerinnen und Wissenschaftler des Max-Planck-Instituts für Marine Mikrobiologie haben nun herausgefunden, dass das so nicht stimmt. Ihre Ergebnisse werfen ein völlig neues Licht auf die Energieversorgung von Zellen in sauerstofffreier Umgebung.
Die Bremer Forschenden haben in einem einzelligen Wimpertierchen aus dem Zugersee in der Schweiz ein Bakterium gefunden, dessen Aufgabe es ist, für das Wimpertierchen zu atmen und es mit Energie zu versorgen. Wobei dieser so genannte Endosymbiont nicht Sauerstoff nutzt, sondern Nitrat. Eine solche Lebensgemeinschaft ist völlig neu.
Im Rahmen dieser Studie kam auch das Umwelt-Rasterelektronenmikroskop zum Einsatz.
Mehr Informationen zur Studie gibt es in der Pressemitteilung "Neue Form der Symbiose entdeckt"
Hier geht es zur Originalveröffentlichung in dem Fachmagazin Nature:
Jon S. Graf, Sina Schorn, Katharina Kitzinger, Soeren Ahmerkamp, Christian Woehle, Bruno Huettel, Carsten J. Schubert, Marcel M. M. Kuypers, Jana Milucka: Anaerobic endosymbiont generates energy for ciliate host by denitrification. Nature, 2021
Wer nutzt das Umwelt-Rasterelektronenmikroskop?
Wissenschaftlerinnen und Wissenschaftler der Abteilung Biogeochemie. Sie steht aber auch anderen Forschenden des Instituts offen sowie externen Forschenden im Rahmen von Kooperationsprojekten.
Kontakt
Wissenschaftler/in
MPI for Marine Microbiology
Celsiusstr. 1
D-28359 Bremen
Germany
|
Raum: |
3130 |
|
Telefon: |


