- Forschung & Instrumente
- Wie wir forschen - Unsere Instrumente und Methoden
- Instrumente und Methoden
- An Land
- Sekundär-Ionen-Massenspektrometer (NanoSIMS)
Sekundär-Ionen-Massenspektrometer (NanoSIMS)

Was kann das NanoSIMS?
NanoSIMS steht für „Nanoscale Secondary Ion Mass Spectrometer“. Es ist ein Massenspektrometer mit einer besonderen Optik, die eine enorme räumliche Auflösung schafft: Wir können damit Dinge beobachten, die 50 Nanometer winzig sind – also ein Zwanzigstel eines Millionstel Meters. Zum Beispiel untersuchen wir so die Strukturen und Vorgänge in einer einzelnen Zelle, sehen ihr quasi beim Arbeiten zu. Das ist nahezu einmalig: Weltweit gibt es nur etwa 50 solcher Geräte. Unseres war eines der ersten, die zur Beantwortung mikrobiologischer Fragestellungen genutzt wurde.
Am MPI Bremen wird das NanoSIMS vor allem für die Element- und Isotopenanalyse von mikrobiologischen Proben aus unterschiedlichen Bereichen der Umwelt verwendet. Mit dieser Methode ist es möglich, den Stoffwechsel von Mikroben zu analysieren. Dabei werden verschiedene chemische Elemente wie Kohlenstoff oder Stickstoff – beides wichtige Nährstoffe für Mikroorganismen – isotopisch markiert. Diese schweren Nährstoffe werden dann von den Mikroben aufgenommen und in ihren Zellen angereichert. Mit dem NanoSIMS können diese Isotopen-Anreicherungen genau gemessen werden, was Aussagen über die Stoffwechsel-Aktivität der einzelnen Zellen ermöglicht.
Die unterschiedlichen Mikrobenarten können vor der NanoSIMS-Analyse mit verschiedenen Methoden, wie zum Beispiel CARD-FISH identifiziert werden. Diese Information erlauben eine Verknüpfung von Identität mit Aktivität und es können dann Aussagen über die Rolle der unterschiedlichen Mikroorganismen in verschiedenen Ökosystemen getroffen werden.
Wie funktioniert das NanoSIMS?

Sekundärionen-Massenspektrometer wie das NanoSIMS bei uns am Institut, verwenden einen feinst fokussierten Primär-Ionenstrahl, in unserem Fall bestehend aus Cäsium- oder Sauerstoff-Ionen, um einen kleinen Teil der Probenoberfläche abzutragen und zu ionisieren. Dabei kann der primäre Ionenstrahl auf einen sehr kleinen Punkt fokussiert werden, bis zu einer Strahlgrösse zwischen 50 und 150 Nanometer.
Danach werden die durch den Primär-Ionenstrahl gebildeten Sekundär-Ionen in ein Massenspektrometer eingeleitet und entsprechend der Masse aufgetrennt. Die hohe Massenauflösung des Massenanalysators ermöglicht die Trennung von Interferenzen (Überlagerungen) von unterschiedlichen Ionen, die die gleiche Masse haben. Zum Beispiel befindet sich bei Masse 32, wo wir das 32iger Isotop von Schwefel (32S) messen, auch das 16O2 Molekül. Diese können von unserem NanoSIMS unterschieden werden. Im Multikollektor können dann diese einzelnen Ionen gezählt werden. Durch die sehr hohe Empfindlichkeit des Instruments können sehr kleine Probenmengen analysiert werden. Die Häufigkeit der einzelnen Ionen, die bei den verschiedenen Detektoren ankommen, können dann in Ionen- und Massen-Verteilungsbildern visualisiert werden.
Die Ausstattung des NanoSIMS
Das MPI in Bremen ist mit einem NanoSIMS 50L von CAMECA ausgerüstet. Dabei handelt es sich um ein Sekundärionen-Massenspektrometer (SIMS), das für hohe laterale Auflösung im Bereich von 50 bis 150 Nanometern (nano) optimiert ist. Ausgestattet ist es mit zwei verschiedenen Ionenquellen zur Primärstrahlerzeugung. Zur Messung von negativ geladenen Sekundär-Ionen, wie Kohlenstoff, Stickstoff, Schwefel und Phosphor, benutzen wir eine Cäsium-Ionenquelle.
Zusätzlich ist unser Instrument mit einer Radiofrequenz-Plasma-Sauerstoff-Ionenquelle zur Messung von positiv geladenen Sekundärionen ausgerüstet. Ein Multikollektor mit sieben Detektoren dient der Detektion der Sekundärionen. Jede Detektorposition ist mit einem Faraday-Detektor und einem Elektronenmultiplier ausgerüstet.
Das NanoSIMS im Einsatz
Vorbereitung einer Probe mit dem LMD
Bevor eine Analyse mit dem NanoSIMS durchgeführt werden kann, müssen die Bereiche markiert werden, in denen sich die Zellen befinden, die analysiert werden sollen. Dies wird mit einem Laser-Dissektionsmikroskop (Leica LMD 6500) gemacht. Diese Markierungen Kennzeichnen erleichtern die Orientierung während der Analyse mit dem NanoSIMS.
Das Laser-Dissektionsmikroskop ist mit verschiedenen Objektiven (10x - 63x) und Lichtfiltern (z.B. DAPI, Cy3, Cy5, Alexa594) ausgestattet, um einzelne Zellen zu identifizieren, markieren, oder auch auszuschneiden. Dabei wird ein UV-Laser (Wellenlänge: 355 nm, Pulsfrequenz: 80 Hz, Pulslänge: <4 ns, avg. Pulsenergie 70 μJ) verwendet. Bilder von markierten Bereichen werden mit einer CC7000 Farbkamera aufgenommen.
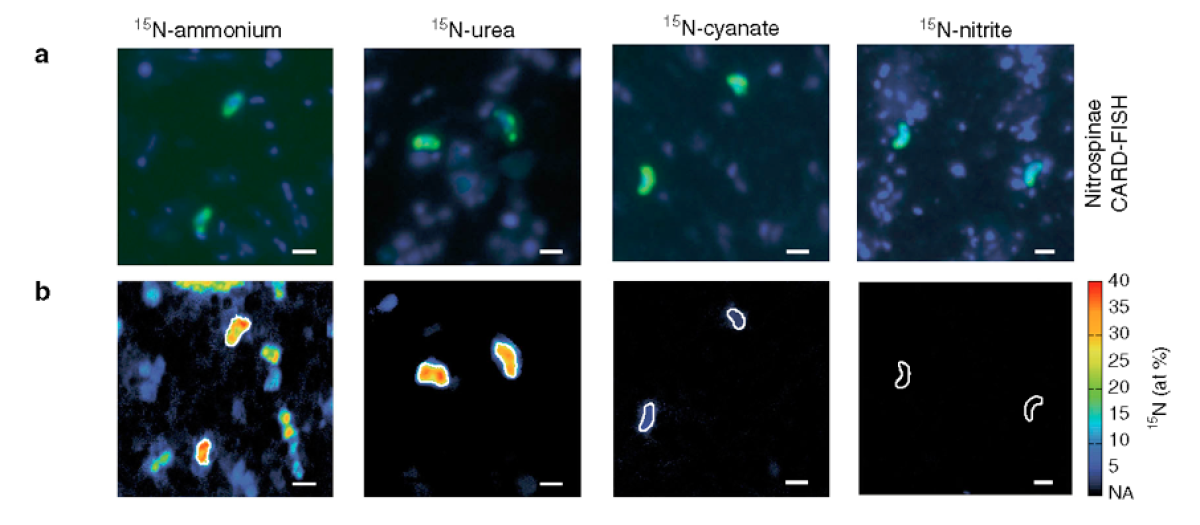
a) Repräsentative CARD-FISH-Bilder von Nitrospinae (grün, gefärbt mit Sonde Ntspn759) und anderen Zellen (blau, gefärbt mit DAPI).
b) Entsprechendes NanoSIMS-Bild von 15N at% Anreicherung nach Zugabe von 15N-Ammonium, Harnstoff, Cyanat oder Nitrit. Nitrospinae sind durch weiße Umrisse gekennzeichnet. Der Maßstabsbalken ist in allen Bildern 1μm.
Einblick in die Lebensstrategien von zwei Gruppen nitrifizierender Mikroorganismen
Nitrifikation ist die Umwandlung der Stickstoffverbindung Ammoniak erst in Nitrit und dann in Nitrat. Den ersten Schritt dieser zweigeteilten Umwandlung im Meer führen Ammoniak oxidierende Archaeen aus. Sie verarbeiten das Ammonium zu Nitrit. Den zweiten Teil, die Verwandlung von Nitrit zu Nitrat, übernehmen Nitrit-oxidierende Bakterien, vor allem Nitrospinae. Allerdings gibt es von diesen Bakterien zehn Mal weniger als von den Ammoniak-oxidierenden Archaeen.
Um diesen Unterschied in der Häufigkeit zu erklären, untersuchten Forschende des MPI Bremen die Biomasse der Mikroorganismen sowie die Wachstumsraten und Aktivität einzelner Zellen unter anderem mit dem NanoSIMS. Sie konnten zeigen, dass die Nitrospinae deutlich aktiver sind und sehr viel schneller wachsen als die Ammoniak-oxidierenden Archaeen. Nitrospinae sind somit deutlich effizienter als die Archaeen.
Gleichzeitig untersuchten die Forschenden mit dem NanoSIMS, welche Stickstoffverbindungen die Partner Ammoniak-oxidierende Archaeen und Nitrospinae für ihr Zellwachstum nutzen. Sie stellten fest: Während die Archaeen fast ausschließlich Ammonium verwenden, nutzen Nitrospinae vor allem organischen Stickstoff, in Form von Harnstoff und Cyanat.
Weitere Details zum Thema gibt es in der Pressemeldung: "Rätsel um Recycling-Truppe im Meer gelöst
Die dazugehörige Publikation in Nature Communications ist hier zu finden:
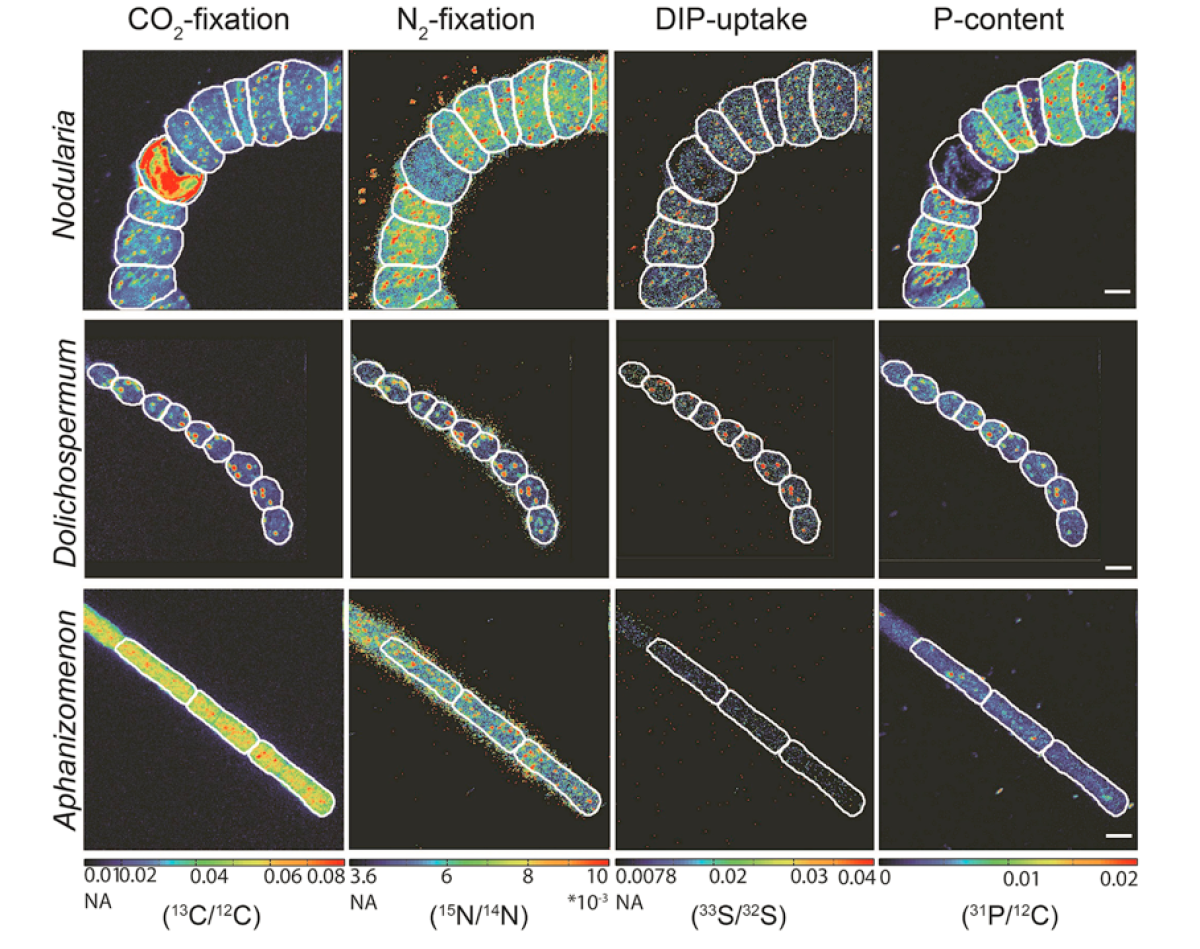
Visualisierung der Phosphor-Aufnahme bei verschiedenen Cyanobakterien aus der Ostsee
Phosphor ist ein essenzielles Element für die Zellphysiologie von Mikroben. Es war uns möglich eine Methode basierend auf NanoSIMS-Analytik zu entwickeln, welche die Quantifizierung der Phosphor-Aufnahme einzelner Zellen in Kombination mit zellulärer CO2- und N2-Fixierung erlaubt. Über die Aufnahme von 33P in die Zellstruktur und dem radioaktiven Zerfall von 32P zu 32S kann über die Veränderung des 32S/33S-Verhältnisses die anorganische Phosphor-Aufnahme in den Zellen visualisiert und gemessen werden.
Damit konnte auch der unterschiedliche Einfluss von Phosphor auf das Wachstum von verschiedenen Cyanobakterien-Arten in der Ostsee dargestellt werden. Es konnte dabei gezeigt werden, dass die Phosphatverfügbarkeit in der Ostsee eine kritische Rolle bei der Entstehung von Nodularia-Blüten ("HAB"-schädliche Algenblüten) spielen kann.
Die dazugehörige Publikation in Scientific Reports ist hier zu finden: https://www.nature.com/articles/s41598-018-35310-w
Übersicht der Forschungsprojekte aus der Abteilung Biogeochemie, in denen das NanoSIMS regelmäßig angewendet wird:
Nutzer
Das NanoSIMS wird vorwiegend von Mitgliedern der Abteilung Biogeochemie verwendet, aber auch andere Forschende des Instituts nutzen das Gerät. Außerdem wird das NanoSIMS auch von externen Wissenschaftlerinnen und Wissenschaftlern in gemeinsamen Projekten genutzt. Bei Interesse wenden Sie sich bitte an untenstehende Kontakte.
Kontakt
Wissenschaftler/in
MPI for Marine Microbiology
Celsiusstr. 1
D-28359 Bremen
Germany
|
Raum: |
3130 |
|
Telefon: |

Technikerin
MPI for Marine Microbiology
Celsiusstr. 1
D-28359 Bremen
Germany
|
Raum: |
3131 |
|
Telefon: |
