Raman-Spektrometer
Was ist Raman-Spektrometrie?
Die Raman-Spektrometrie ist nach dem indischen Physiker C. V. Raman benannt. Raman hat im Jahr 1928 als erster den Effekt nachgewiesen, dass Licht an Molekülen oder Festkörpern unelastisch gestreut wird. Das heißt, dass ein Teil der Bewegungsenergie des Lichts auf das Molekül oder den Festkörper übergeht und ihn somit anregt. Um diesen Effekt geht es bei der Raman-Spektroskopie.
Wofür nutzt man Raman-Spektrometrie?
Mit dem Raman-Spektrometer werden Materialeigenschaften untersucht. Mit Materialeigenschaften ist die Zusammensetzung der chemischen Verbindungen eines Objekts oder einer Probe gemeint, aber auch Eigenschaften wie die Art der Struktur, in der die Moleküle, Atome oder Ionen angeordnet sind (Kristallinität) oder eventuell enthaltene Fremdatome (Dotierung). Eingesetzt wird die RAMAN-Spektroskopie in vielen verschiedenen Bereichen, zum Beispiel in der Mineralogie zur Identifizierung von Mineralien, in der Archäologie zur Untersuchung von Funden, in der Lebensmittelchemie zur Untersuchung von Kohlenhydraten als Bestandteil von Nahrungsmitteln und so weiter. Bei uns am Institut verwenden wir das Gerät zur Untersuchung von biologischen Proben. Wir arbeiten mit Bakterienkulturen oder Mikroorganismen aus verschiedenen Habitaten, zum Beispiel aus dem Ozean aber auch aus Süßwasser-Seen.
Der große Vorteil des Geräts ist, dass zerstörungs- und kontaktfrei gemessen werden kann, sowie dass nur sehr kleine Mengen einer biologischen Probe benötigt werden. So hilft die RAMAN-Spektroskopie beispielsweise dabei Aussagen treffen zu können, ob Bakterien in einer Wasserprobe bestimmte Speicherstoffe enthalten. Die Speicherstoffe können je Spezies unterschiedlich sein.
Wie funktioniert das Raman-Spektrometer?
Mit einem Spektrometer können – wie der Name schon sagt – Spektren dargestellt werden. Ein Spektrum wiederum ist ganz allgemein das Anzeigen von Häufigkeiten oder Intensitäten von Objekten in einer Menge, die alle eine gemeinsame Eigenschaft haben. Am bekanntesten ist sicherlich das Farbspektrum. Hier werden unterschiedliche Wellenlängen von Licht als Farben sichtbar. Bei uns am Institut arbeiten wir zumeist mit Massenspektren, die zu den nicht optischen Spektren zählen. Als Ergebnis erhält man ein Strichspektrum, in dem Häufigkeiten in Peaks angezeigt werden.
Bei der Raman-Spektroskopie macht man sich die Rotation, Schwingung und Neuausrichtung des Spins eines Teilchens bei Anregung mit dem (monochromatischen) Lichtes eines Lasers zunutze was bedeutet dass beim Einstrahlen des Lasers auf die Probe die Moleküle anfangen zu schwingen, sich zu dehnen oder zu strecken oder sich zu biegen und zu deformieren. Diese Bewegung bzw. Änderung lässt sich dann in einem Spektrum zeigen.
Dies passiert zum Beispiel bei Bindungen zwischen Kohlenstoff und Kohlenstoff oder Schwefel und Schwefel, aber auch bei Kohlenstoff- und Sauerstoffverbindungen und vielen anderen. Das an der Probe gestreute Licht ergibt ein Spektrum und sieht jeweils anders aus.
Die Wellenlänge des Lasers kann unterschiedlich sein. Meistens werden Laser mit längeren Wellenlängen verwendet. Unser System hat einen roten Laser mit der Wellenlänge 785 Nanometer und einen grünen Laser mit der Wellenlänge von 532 Nanometer.
Bei der konfokalen Raman-Spektroskopie wird nur ein kleiner Teil der zu untersuchenden Probe mit dem Laserlicht beleuchtet und nicht fokussiertes Licht wird abgeschirmt. Das erhöht die Tiefenschärfe und den Kontrast. Dies lässt sich auch auf einen dreidimensionalen Scan ausweiten. Eine zerstörungsfreie, kontaktfreie Messung bei nur kleinen Mengen benötigten Probenmaterials (biologische Proben) ist möglich. Die laterale Auflösung ist dabei unter 200 Nanometer und die Belichtungszeit liegt nur bei Sekunden oder Millisekunden.
Das Raman-Spektrometer im Einsatz
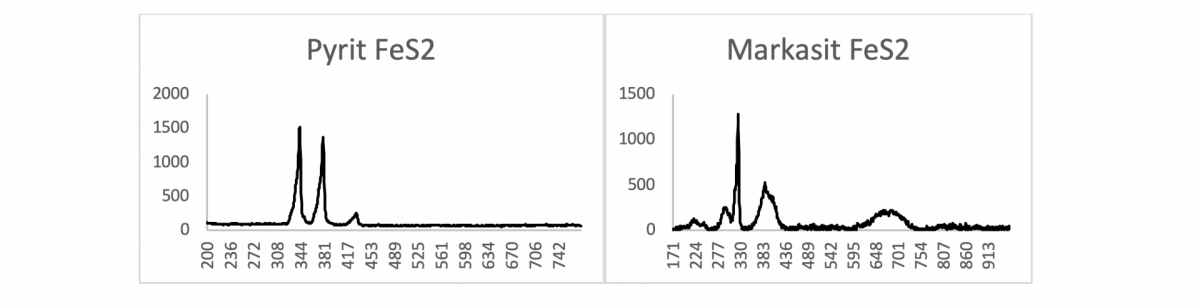
Die Raman-Spektroskopie ermöglicht zum Beispiel Aussagen darüber ob es sich bei dem untersuchten Material um eine dimorphe oder polymorphe Struktur handelt. Das heißt, bei Verbindungen, die die gleiche Summenformel haben, wie es bei den Mineralen Pyrit und Markasit der Fall ist (beide haben die Summenformel FeS2), kann die Raman-Messung die beiden Mineralien anhand ihrer unterschiedlichen Strukturen unterscheiden.
Die Unterschiede werden in ihren Spektren sichtbar:
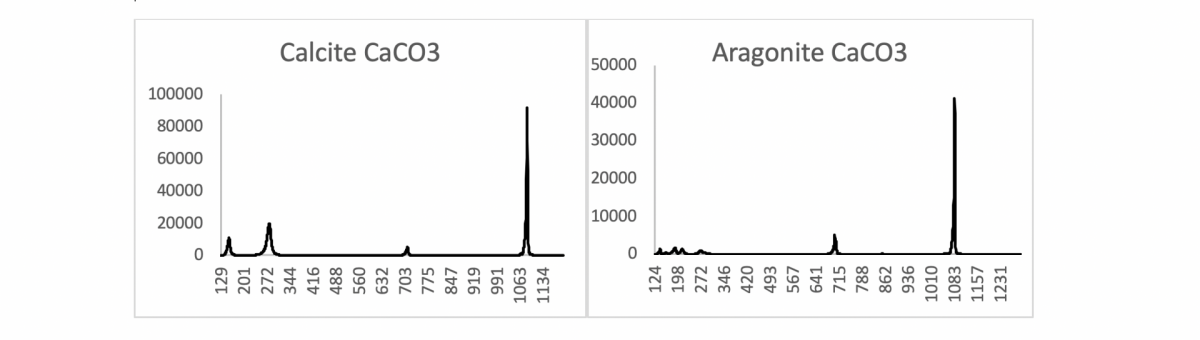
Oder wie im folgenden Beispiel von Calcit und Aragonit (beide sind Calciumcarbonat CaCO3):
Auch in verschiedenen wässrigen Systemen (biotischen und abiotischen) findet die Raman-Spektroskopie Anwedung für uns. So konnte gezeigt werden wo bestimmte Bakterien ihre Speicherstoffe einlagern und was sich in den Bereichen befand.
Im folgenden Beispiel wurden Bakterienfilamente der Spezies Beggiato spp. mit dem Raman untersucht und mit Hilfe eines Rasterscannes die Spektren verschiedener Bereiche einer Fläche aufgenommen:
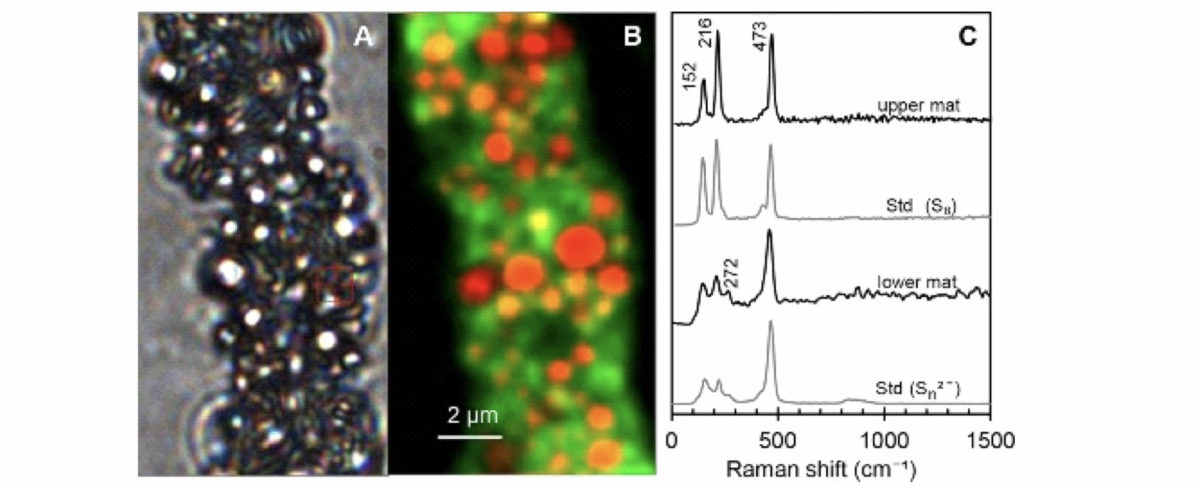
B) Der gleiche Abschnitt des Filamentes wurde mit dem Raman während eines Rasterscannes aufgenommen. In gelb/rot sieh man den Schwefel (Hauptpeak bei 473 cm-1) und die Autofluoreszenz der Zellen in grün.
C) Ein aufgenommenes Spektrum auf einem gelben/roten Punkt zeigt Schwefeleinschlüsse in Form von Cyclooktaschwefel und als Polysulfid. Oben ist ein Spektrum einer oberen Bakterienmatte und im dritten Spektrum von oben eine untere Bakterienmatte zu sehen. Ganz unten ist das Spektrum von Polysulfide.
Publikation: Polysulfides as Intermediates in the Oxidation of Sulfide to Sulfate by Beggiatoa spp., Jasmine S. Berg et al, Applied and Environmental Microbiology, 2013
Das Bild A ist ein Lichtmikroskop-Bild und zeigt ein Filament der Spezies Beggiato spp.
Das oben gezeigte Beispiel stammt aus einer Publikation über Polysulfide als Zwischenprodukte bei der Oxidation von Sulfiden zu Sulfaten durch Beggiatoa spp.
Zum Vergleichen wurden Standards gemessen. Dieser war elementarer Schwefel, welcher strukturell in Ringform vorliegt (Cycloocta-Schwefel). Dieser Schwefel-Ring zeigt drei charakteristische Peaks (an zweiter Stelle zu sehen in Bild C). In der oberen Matte der Beggiato spp.-Kolonie wurden ebenfalls die drei Peaks im Raman-Spektrum gefunden (siehe erstes Spektrum in Bild C). Das bedeutet, dass auch hier Cycloocta-Schwefel vorliegt. Das untere Spektrum in Bild C zeigt einen Standard von Schwefel in Kettenstruktur (Polysulfid). Das Spektrum ist anders, die beiden ersten Peaks sind kleiner als bei der Cycloocta-Form. Diese Struktur wurde ebenfalls in der unteren Matte einer Beggiato spp.-Kolonie gefunden.
Eine weitere gängige Methode ist der Rasterscan, auch Raman Mapping genannt. Hier werden viele einzelne Punktspektren aufgenommen, die Linie für Linie über einem bestimmten Bereich zu einem großen Bild zusammengefasst werden.
Sie helfen die Bereiche der Zellen zu finden, in denen Speicherstoffe vorhanden sind und wo viel und wo weniger Speicherstoffe sind. Das Ergebnis eines solchen Rasterscans sieht man in Bild B. Es zeigt ein Beggiato spp. Filament mit roten und orangenen Bereichen. In diesen Bereichen befinden sich Spektren des Schwefels. In Grün wird die Autofluoreszenz der Zelle angezeigt.
Wer benutzt das Raman-Spektrometer?
Wissenschaftlerinnen und Wissenschaftler, Doktorandinnen und Doktoranden, Technikerinnen und Techniker der Abteilung Biogeochemie, Marmic-Studierende während der Lab-Rotation oder auch Gaststudierende.
Kontakt
Gruppenleiterin
Forschungsgruppe Treibhausgase
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
Deutschland
|
Raum: |
3128 |
|
Telefon: |

Wissenschaftler/in
MPI for Marine Microbiology
Celsiusstr. 1
D-28359 Bremen
Germany
|
Raum: |
3130 |
|
Telefon: |

Technikerin
MPI for Marine Microbiology
Celsiusstr. 1
D-28359 Bremen
Germany
|
Raum: |
3131 |
|
Telefon: |


