- Presse
- Pressemeldungen
- Zellkernparasiten in Tiefseemuscheln
Übernahme der Schaltzentrale der Zelle: Zellkernparasiten in Tiefseemuscheln
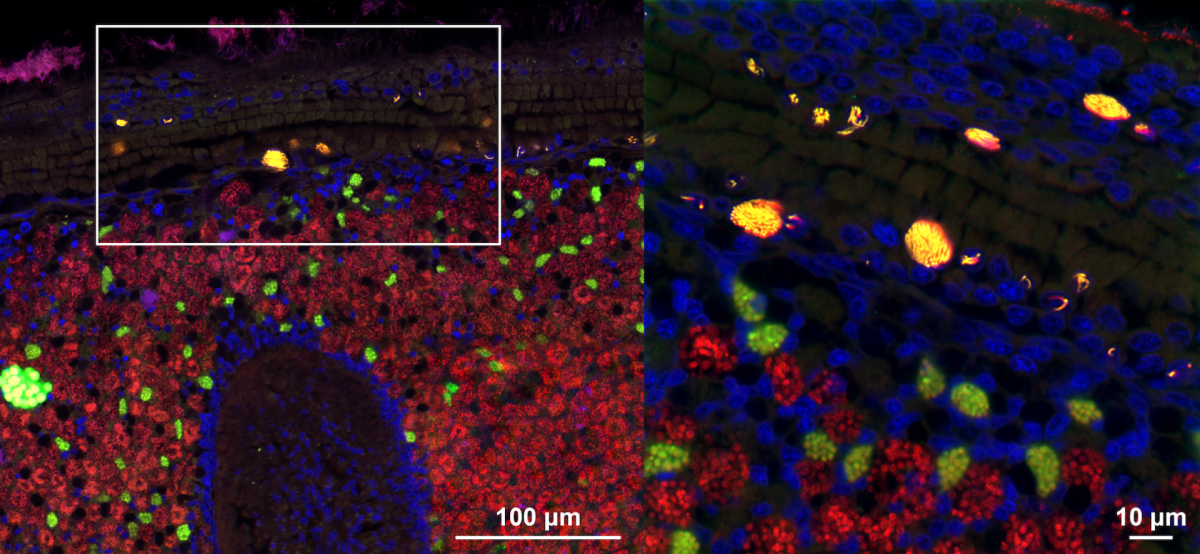
Die meisten Tiere leben in enger Verbindung mit Bakterien. Einige dieser Bakterien wohnen in den Zellen ihrer Wirte, doch nur sehr wenige können innerhalb von Zellorganellen (Strukturen innerhalb der Zelle, wie Organe im Körper) leben. Eine Gruppe von Bakterien hat einen Weg gefunden, sogar die Zellkerne ihrer Wirte zu besiedeln – eine bemerkenswerte Leistung angesichts dessen, dass der Zellkern die Schaltzentrale der Zelle ist.
Bislang wusste man nichts über die molekularen und zellulären Prozesse, mit denen diese intranukleären Bakterien ihre tierischen Wirte infizieren und sich dort vermehren. Eine Gruppe von Forschenden des Max-Planck-Instituts für Marine Mikrobiologie in Bremen präsentiert nun in einer in Nature Microbiology veröffentlichten Studie die erste eingehende Analyse eines intranukleären Parasiten von Tieren.
Massenvermehrung in der Zelle, ohne sie dabei zu töten
Dieser intranukleäre Parasit namens Candidatus Endonucleobacter infiziert die Zellkerne von Tiefseemuscheln an hydrothermalen Schloten und kalten Quellen weltweit. Eine einzige Bakterienzelle dringt in den Zellkern einer Muschel ein und vermehrt sich dann auf über 80.000 Zellen, wodurch der Zellkern auf das 50-fache seiner ursprünglichen Größe anschwillt. “Wir wollten verstehen, wie das Bakterium den Zellkern befällt und sich darin fortpflanzt. Insbesondere wollten wir herausfinden, wie diese Bakterien an die Nährstoffe gelangen, die sie für ihre massive Vermehrung benötigen, und wie sie gleichzeitig verhindern, dass ihre Wirtszellen absterben”, sagt Niko Leisch, der zusammen mit Nicole Dubilier von der Abteilung Symbiose am Max-Planck-Institut für Marine Mikrobiologie Hauptautor der Studie ist.
Mithilfe einer Reihe von molekularen und bildgebenden Verfahren zeigen die Forschenden, dass Ca. Endonucleobacter von Zuckern, Lipiden und anderen Zellbestandteilen seines Wirts lebt. Es verdaut nicht die Nukleinsäuren seines Wirts, wie viele andere intranukleäre Bakterien das tun. Mit dieser Ernährungsweise stellt Ca. Endonucleobacter sicher, dass die Wirtszelle lange genug funktioniert, um ausreichend Nährstoffe für seine massenhafte Vermehrung zu produzieren.
Wettrüsten um die Kontrolle über die Zelle
Oft reagieren tierische Zellen auf eine Infektion mit Apoptose – einem Selbstmordprogramm, das Zellen einleiten, wenn sie durch Bakterien oder Viren angegriffen oder geschädigt werden. "Interessanterweise haben diese Bakterien eine ausgeklügelte Strategie entwickelt, um ihre Wirtszellen am Selbstmord zu hindern", sagt Erstautor Miguel Ángel González Porras. "Sie produzieren Proteine, die die Apoptose unterdrücken, sogenannte Apoptose-Inhibitoren (IAPs)." Es beginnt ein Wettrüsten um die Kontrolle des Zelltods: Während die Bakterien immer mehr IAPs produzieren, steigert die Wirtszelle ihre Produktion von Proteinen, die die Apoptose auslösen. Letztendlich, nachdem der Parasit genug Zeit hatte, sich massenhaft zu vermehren, zerreißt die Wirtszelle, wodurch die Bakterien freigesetzt werden und neue Wirtszellen infizieren können.
Nicole Dubilier ergänzt: “Die Entdeckung der IAPs in Ca. Endonucleobacter war eines der überraschendsten Ergebnisse unserer Studie. Denn diese Proteine sind nur von Tieren und einigen wenigen Viren bekannt, wurden aber noch nie in Bakterien gefunden.” Die Analyse der evolutionären Beziehungen der IAPs durch die Forschenden ergab, dass der Parasit diese Gene wahrscheinlich durch horizontalen Gentransfer (HGT) von seinem Wirt erworben hat. Während HGT von Bakterien auf Eukaryonten gut bekannt ist, gibt es nur sehr wenige Beispiele für HGT in umgekehrter Richtung, wie er in der hier präsentierten Studie gefunden wurde.

Bedeutung für die Evolution und die Medizin
“Unsere Entdeckung trägt dazu bei, dass wir die Wechselwirkungen zwischen Wirt und Mikrobe besser verstehen und verdeutlicht die komplexen Strategien, die Parasiten entwickelt haben, um in ihren Wirten zu gedeihen”, erklärt Nicole Dubilier. Diese Erkenntnisse könnten weitreichende Auswirkungen auf die Untersuchung von parasitären Infektionen und Strategien zur Umgehung des Immunsystems in anderen Organismen haben. “Unsere Forschung beleuchtet einen übersehenen Mechanismus des genetischen Austauschs – HGT von Eukaryonten auf Bakterien –, der unser Verständnis der mikrobiellen Evolution und Pathogenese verändern kann. Darüber hinaus bietet unsere Studie Einblicke in die Regulierung der Apoptose, die für die Krebsforschung und die Zellbiologie von Bedeutung ist,” so Niko Leisch abschließend.
Originalveröffentlichung
Beteiligte Institutionen
Max-Planck-Institut für Marine Mikrobiologie, Bremen, D-28359, Deutschland
Alkek Center for Metagenomics and Microbiome Research, Baylor College of Medicine, Houston, TX 77030, USA
Department of Plant and Microbial Biology, North Carolina State University, Raleigh, NC 27695, USA
Zoologisches Institut, Christian-Albrechts-University, Kiel, D-24118, Deutschland
European Molecular Biology Laboratory, Heidelberg, D-69117 Deutschland
Kontakt
Direktorin
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
3241 |
|
Telefon: |

Pressereferentin
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
1345 |
|
Telefon: |

Dr. Miguel Miguel Ángel González Porras
Max-Planck-Institut für Marine Mikrobiologie, Bremen, Deutschland
E-Mail: [Bitte aktivieren Sie Javascript]