- Forschung & Instrumente
- Wie wir forschen - Unsere Instrumente und Methoden
- Instrumente und Methoden
- An Land
- Konfokales Laser-Scanning Mikroskop
Konfokales Laser-Scanning Mikroskop

Was kann das konfokale Laser-Scanning Mikroskop?
Am Max-Planck-Institut für Marine Mikrobiologie untersuchen wir hauptsächlich Mikroorganismen aus der Umwelt, die oft kleiner als ein Mikrometer sind. Sie sind unter einem Lichtmikroskop daher nur als ein Fleck zu erkennen. Alles, was kleiner ist als 200 Nanometer, kann nicht mehr präzise erkannt werden. Die Hauptaufgabe eines Konfokalmikroskops ist, ein möglichst genaues Bild von sehr sehr kleinen Objekten darzustellen. Es erlaubt einen detaillierteren Blick auf die Mikroben als ein Standard-Lichtmikroskop.
Warum ist das konfokale Laser-Scanning Mikroskop wichtig?
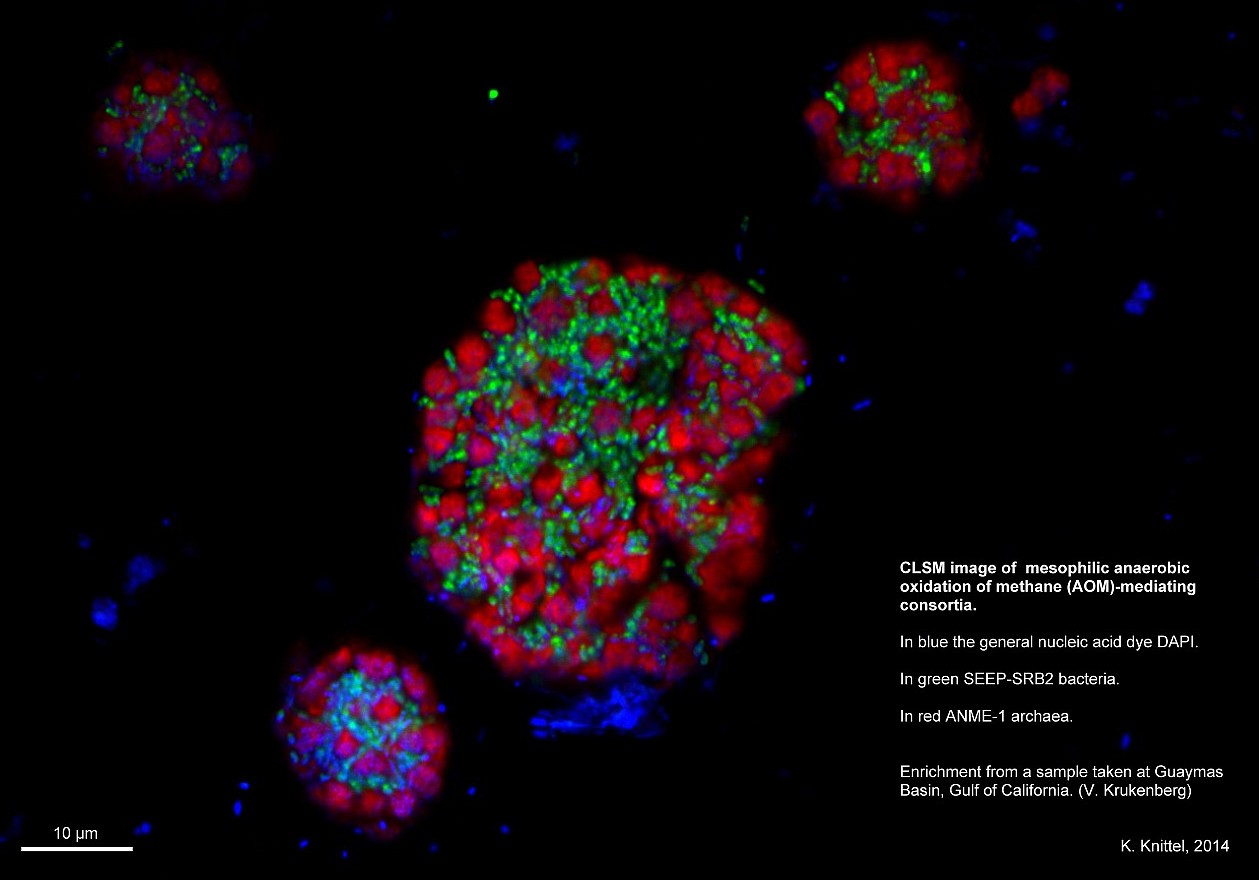
Zwar ist es möglich, die Bakterien mit Fluorsenz-Farbstoffen einzufärben und unter einem Fluorsenz-Lichtmikroskop sichtbar zu machen. So können sie zum Beispiel in einer Wasserprobe nachgewiesen und gezählt werden. Aber sie sind „nur“ als Farbfleck zu sehen – Strukturen sind kaum erkennbar. Außerdem ist die Darstellung oft unscharf, da bei einer hohen Vergößerung jene Ebenen, die eigentlich nicht im Fokus stehen, das Bild verschwimmen lassen – vergleichbar mit einem Porträtbild, auf dem der Hintergund unscharf ist.
Hier kommt das konfokale Laser-Scanning Mikroskop ins Spiel. Mit diesem Gerät kann jeweils die Ebene oder Schicht betrachtet werden, die im Sinne des Forschenden relevant ist. Das bedeutet: Alles, was nicht im Fokus steht, wird ausgeblendet. Dadurch entsteht ein schärferes Bild. So können Strukturen, die zuvor verschwommen waren, deutlicher erkannt werden. Dadurch werden wiederum Rückschlüsse über den Aufbau eines Mikroorganismus ermöglicht.
Wie das Konfokalmikroskop funktioniert
Das konfokale Laser-Scanning Mikroskop nutzt einen Trick mit Licht. Bei normalen Lichtmikroskopen als auch beim Fluorsenzmikroskop wird das ganze Präparat ausgeleuchtet – das ist bei einem Konfokalmikroskop anders. Hier wird wird ein Laser verwendet, der den Bereich, der von Interesse ist, Punkt für Punkt rastert. Eine Software setzt anschließend die Informationen zu einem Bild zusammen. Das Fluorsenzlicht wird dabei durch eine Lochblende gebündelt, welche die Bereiche außerhalb des Fokus ausblendet. So entsteht am Ende ein schärferes Bild ohne störende Überlagerungen.
Es gibt aber noch mehr Methoden um zu erreichen, dass bei gleichbleibender Auflösung mehr auf den Bildern zu sehen ist. Dafür verfügt das Konfokalmikroskop über zwei Erweiterungen: einen Airyscan-Detektor und das Hochauflösungssystem ELYRA mit den Techniken SR-SIM und PALM beziehungsweise dSTORM.
Airyscan
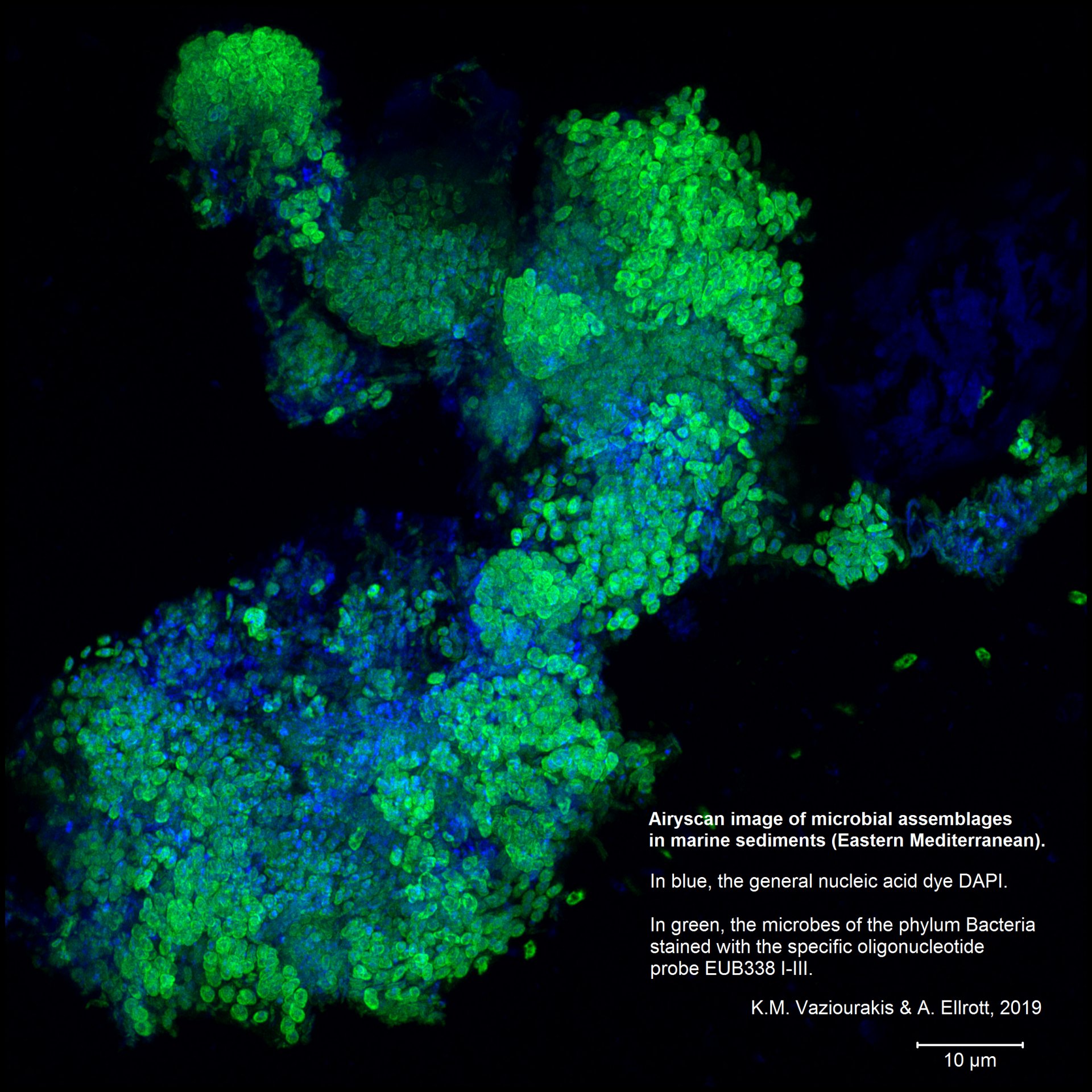
Ein Problem, dass bei einem Konfokalmikroskop entstehen kann, ist, dass zu wenig Licht vorhanden ist. Denn eine fast geschlossene Lochblende erlaubt zwar eine starke Fokussierung – aber es ist eben auch fast dunkel, da ja kaum noch Licht durchkommt. Die Stärke des Konfokalmikroskops wird also dann zu einer Schwäche, je mehr die Lochblende geschlossen wird. Airyscan löst dieses Problem. Es besteht aus mehreren kreisförmig angeordneten Detektoren und sieht aus wie ein Facettenauge. Jeder einzelne Detektor hat den Durchmesser einer fast geschlossenen Lochblende und „sieht“ somit seinen Ausschnitt so scharf wie möglich. Da es in unserer Ausführung des Airyscan insgesamt 32 solcher Detektoren gibt, die alle einen bestimmten Fokuspunkt haben, ist in der Summe genug Licht vorhanden, um etwas zu erkennen.
Mit Airyscan wird eine 1,7 fache höhere Auflösung im Vergleich zur Standardmikroskopie erreicht und die Auflösungsgrenze bis auf 140 Nanometer nach unten verschoben.
ELYRA
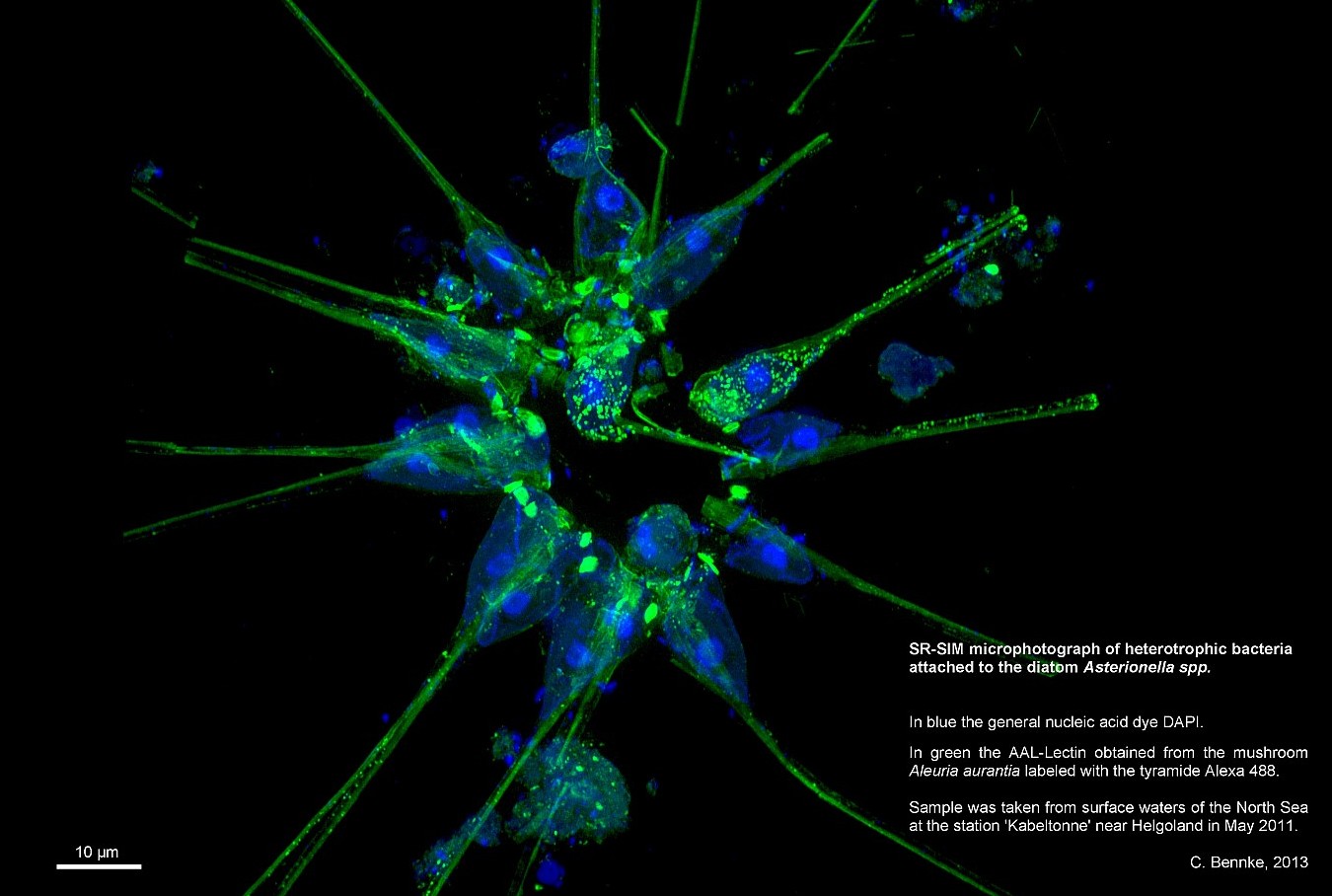
Das ELYRA-System beinhaltet zwei Techniken für hochauflösende Bilder. Die erste heißt Superresolution Structured Illumination (SR-SIM), auf deutsch hochauflösende strukturierte Beleuchtung. Sie basiert auf dem Moiré-Effekt. Das ist der Effekt, der entsteht, wenn sich zwei Streifenmuster überlagern. Wenn z.B. im Fernsehen jemand ein gestreiftes Hemd trägt sieht das Publikum vor den Bildschirmen ein Flimmern des Musters. Ursache des Flimmerns ist die gekreuzte Überlagerung der Hemdstreifen mit den Bildzeilen der Kamera. Dieser Effekt lässt sich berechnen.
Die SR-SIM-Methode funktioniert nun so, dass das Bakterium mit einem Streifenmuster beleuchtet und ein Bild davon gemacht wird. Der Moirè-Effekt entsteht dann dort, wo natürliche „Streifen“-strukturen im Präparat sind. Dies wird mehrfach mit unterschiedlichen Positionen wiederholt. Eine Software kann anschließend aus den in den aufgenommen Bildern vorhandenen Moirè-Mustern auf die natürlichen Strukturen des Präparats zurückrechnen und ein Bild erstellen. Im besten Fall ist es möglich, Strukturen mit einer Auflösung bis zu 100 Nanometer zu erkennen – es ermöglicht also doppelt so gut zu sehen, wie mit einem Lichtmikroskop.
Die zweite Technik der ELYRA-Erweiterung am konfokalen Mikroskop unseres Instituts ist die photoaktivierte Lokalisations-Mikroskopie (PALM). Das ist eine aufwändige Methode, da die Probe dafür speziell vorbereitet werden muss. Sie basiert auf Fluorsenz und nutzt aus, dass wenn nicht alle Fluoreszenz-Moleküle zur gleichen Zeit leuchten, die Mitte eines jeden Leuchtpunktes der Position eines einzelnen Fluoreszenz-Moleküls entspricht. Die Probe wird dafür so vorbereitet, dass die Moleküle blinken, sodass möglichst nie zwei benachbarte Moleküle zur gleichen Zeit leuchten. Diese Lichtpunkte werden dann gemessen und in einer Tabelle dargestellt. Der Output dieser Methode ist also nicht in erster Linie eine Bild, sondern eine Tabelle mit den Koordinaten der Lichtpunkte. Daraus lässt sich aber bei Bedarf ein Bild errechnen. Theoretisch ist mit PALM eine Auflösung bis zu 20 Nanometer möglich.
Wer nutzt das konfokale Laser-Scanning Mikroskop?
Das Konfokalmikroskop wird von der Abteilung Molekulare Ökologie betrieben. Es steht aber allen Abteilungen und Gruppen zur Verfügung. Die Nutzung durch Externe ist auf Antrag, zum Beispiel im Rahmen einer Kooperation, möglich.
Jeder neue Nutzer muss zunächst eine Einweisung erhalten. Diese wird auf Anfrage von Andreas Ellrott oder Katrin Knittel erteilt und soll neben dem Sicherheitsaspekt im Wesentlichen dazu beitragen, ein tieferes Verständnis des Systems und der Software zu erlangen. Es sollen am Ende nicht nur schöne Bilder, sondern schöne UND wissenschaftlich korrekte Bilder aufgenommen werden.
Informationen zu technischen Details und Reservierung gibt es unter:
Molekulare Ökologie > Schlüsseltechnologien > CLSM
LESETIPP: Eine Schülerin aus Bremen hat zwei Wochen bei uns am Institut Praktikum gemacht und ihre Erfahrungen mit dem Konfokalmikroskop hier aufgeschrieben: "Olavius im Rampenlicht"
Kontakt
Dipl.-Ing. (FH)
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
2204 |
|
Telefon: |

Projektleiterin
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
2222 |
|
Telefon: |