- Presse
- Pressemeldungen
- Nicht über den Hunger essen
Nicht über den Hunger essen: Wie Archaeen ihre Stickstoffaufnahme schalten
Leben braucht Stickstoff. Lebewesen haben viele verschiedene Strategien entwickelt, um an Stickstoff zu kommen. Menschen beispielsweise essen deswegen die stickstoffreichen Proteine. Die meisten Mikroorganismen nehmen Stickstoff in Form von Ammoniak (NH3) auf. Da es energieaufwändig ist, Ammoniak aufzunehmen, und da Energie in der Umwelt üblicherweise Mangelware ist, müssen sie diese Aufnahme streng regulieren. Eine Gruppe von Forschenden um Tristan Wagner vom Max-Planck-Institut für Marine Mikrobiologie in Bremen hat diese Regulierung nun in einer bisher wenig erforschten Gruppe von Mikroorganismen untersucht: den Archaeen.
Archaeen und Bakterien ähneln sich zwar in Größe und Form, gehören aber unterschiedlichen „Domänen des Lebens“ an. Bei Bakterien ist die Regulierung der Stickstoffaufnahme gut erforscht und sehr komplex. Über den Prozess in Archaeen weiß man jedoch vergleichsweise wenig. „Deshalb wollten wir herausfinden, wie das bei diesen wenig erforschten Mikroben funktioniert“, sagt Erstautorin Marie-Caroline Müller. Gemeinsam mit Forschenden der Radboud Universität in den Niederlanden untersuchten sie in zwei methan-produzierenden (methanogene) Archaeen das Enzym, das für die Stickstoffaufnahme verantwortlich ist. Ihre Ergebnisse veröffentlichen sie jetzt im Fachmagazin Communications Biology.
Ein molekularer Schalter – zwei Wege, ihn zu betätigen
Für ihre Experimente nutzten die Forschenden Organismen aus sehr unterschiedlichen Lebensräumen: Die eine Art, Methanothermococcus thermolithotrophicus, stammt aus Sedimenten im Golf von Neapel, die andere, Methermicoccus shengliensis, aus einem Ölfeld in China.
„Generell sind sich die untersuchten Organismen zwar recht ähnlich, aber wir haben festgestellt, dass sie ihre Stickstoffaufnahme ganz unterschiedlich regulieren“, so Müller. Sie benutzen denselben Schalter, um die Stickstoffaufnahme ein- oder auszuschalten, aber sie betätigen ihn auf unterschiedliche Weise.
Zunächst isolierten die Forscher die Glutaminsynthetase – jenes Enzym, das für die energieabhängige Aufnahme von Stickstoff verantwortlich ist – aus beiden Organismen und überprüften seine Aktivität. Hier erlebten sie die erste Überraschung: Während das Enzym aus M. shengliensis wie erwartet aktiv war, war jenes aus M. thermolithotrophicus es nicht. Offensichtlich besaßen beide Organismen dasselbe Enzym für die Stickstoffaufnahme, regulierten es aber unterschiedlich. Sie hatten verschiedene Möglichkeiten, es an- und auszuschalten. M. shengliensis verhielt sich wie erwartet. Aber was war der Auslöser in M. thermolithotrophicus? Die Forschenden versuchten es mit einer Verbindung namens 2-Oxoglutarat, das nachweislich die Aktivität der Glutaminsynthetase in manchen Archaeen erhöht. „Und tatsächlich, es funktionierte!“, sagt Müller. „Das war ein aufregendes Ergebnis. Wir hatten einen Weg gefunden, wie man den Schalter für die Aktivität des Enzyms in M. thermolithotrophicus umlegen kann. Und wir haben es sogar geschafft, die Aufnahme zu regulieren, indem wir die Konzentration von 2-Oxoglutarat veränderten: Wenn die Zelle Stickstoff benötigt, steigt der 2-Oxoglutarat-Spiegel und schaltet die Glutaminsynthetase ein. Hat die Zelle aber genug Stickstoff, sinkt der 2-Oxoglutarat-Spiegel auf eine Konzentration, die zu niedrig ist, um das Enzym aktiv zu halten. Dadurch wird eine weitere Stickstoffaufnahme verhindert. Somit wird keine Energie verschwendet, wenn die Zelle gut mit Stickstoff versorgt ist.“
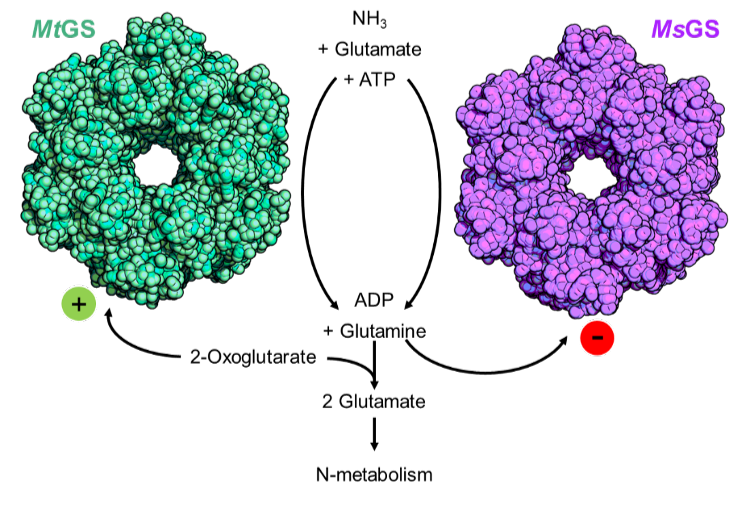
Des Weiteren entdeckten die Forschenden, dass das Enzym von M. shengliensis durch Glutamin – das Molekül, das den Stickstoff in der Zelle trägt – deaktiviert wird. Diese Reaktion wurde bereits bei einigen Bakterien nachgewiesen. Im Gegensatz dazu ist M. thermolithotrophicus unempfindlich gegenüber Glutamin. Das zeigt einmal mehr, wie sehr sich die beiden Mikroben in ihrer Art der Regulierung unterscheiden.
Ähnliche Mikroben, unterschiedliche Methoden
Als nächstes wollten die Forschenden herausfinden, wie genau das 2-Oxoglutarat den Schalter für die Stickstoffaufnahme in M. thermolithotrophicus einschaltet. Mittels Röntgenkristallographie unter Verwendung von Synchrotronstrahlung bestimmten sie die 3D-Struktur des zuvor kristallisierten Enzyms mit und ohne daran gebundenes 2-Oxoglutarat. Außerdem verglichen sie es mit dem anderen untersuchten Organismus, M. shengliensis. Bei M. thermolithotrophicus bindet das 2-Oxoglutarat in einer Tasche weit entfernt vom aktiven Zentrum des Enzyms, in dem die Reaktion stattfindet. Durch die Bindung an 2-Oxoglutarat kommt es zu Verschiebungen im Enzym, sodass es die aktive Form annimmt. Bei M. shengliensis hingegen kann das 2-Oxoglutarat nicht an das Enzym binden, deswegen ruft das 2-Oxoglutarat hier keine Reaktion hervor. „Jetzt können wir ganz genau beschreiben, wie der 2-Oxoglutarat-Schalter funktioniert und welche Enzyme dafür empfänglich sind“, so Müller.
„Selbst eng verwandte Mikroben, wie die methanogenen Archaeen, haben unterschiedliche Wege entwickelt, um die Stickstoffaufnahme zu steuern“, fasst Wagner zusammen. „Dieses von der Evolution geschliffene Regulierungssystem, gezielt und schnell auf die Bedürfnisse der Zelle zu reagieren, ist wunderbar. Und wir rechnen mit noch mehr Überraschungen: Sehr wahrscheinlich warten weitere unvermutete Regulierungssysteme darauf, entdeckt zu werden", so Wagner abschließend.
Originalveröffentlichung
Marie-Caroline Müller, Olivier N. Lemaire, Julia M. Kurth, Cornelia U. Welte, Tristan Wagner (2024): Differences in regulation mechanisms of glutamine synthetases from methanogenic archaea unveiled by structural investigations. Comm. Biol. 2024, veröffentlicht 19. Januar, 2024.
Beteiligte Institutionen
- Max-Planck-Institut für Marine Mikrobiologie, Celsiusstraße 1, 28359 Bremen, Deutschland
- Radboud University, Nijmegen, The Netherlands
Rückfragen bitte an:
Gruppenleiter
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen

Pressereferentin
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
1345 |
|
Telefon: |