Seitenpfad:
- Presse
- Pressemeldungen 2004
- Bakterien korrodieren Eisen
Bakterien korrodieren Eisen
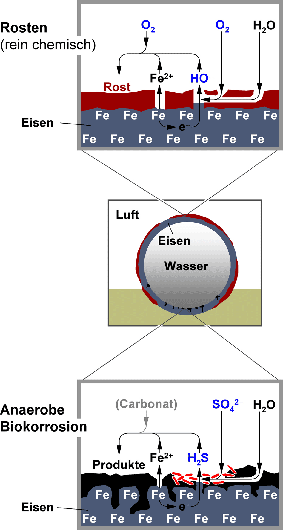
Abbildung 1
Formen der Korrosion am Beispiel eines mit Wasser gefüllten Eisenrohres an der Bodenoberfläche. A: Bei der Korrosion an der Luft, d.h. bei dem bekannten Rosten, reagieren Elektronen aus dem metallischen Eisen (Fe) mit Sauerstoff (O2) und führen unter Beteiligung von Wasser (H2O) zu Hydroxyl-Ionen (HO-). Diese bilden mit dem freigesetzten zweiwertigen Eisen (Fe2+) unter weiterer Mitwirkung von Sauerstoff Rost, ein kompliziert aufgebautes wasserhaltiges Oxid des dreiwertigen Eisens. Soweit bekannt, handelt es sich um einen rein chemischen Vorgang. B: Im Gegensatz dazu wirken bei der Korrosion unter Ausschluß von Luft (bevorzugt am Boden des Rohres, wo sich Schwebstoffe ablagern) Bakterien (rot) mit, die ohne Sauerstoff leben. Deshalb spricht man von anaerober Biokorrosion. Am wichtigsten sind sulfatreduzierende Bakterien. Auf eine noch nicht in allen Details geklärte Weise dienen die Elektronen aus dem Eisen zur Reduktion von Sulfat zu Schwefelwasserstoff (H2S), was den Bakterien die für Ihr Wachstum benötigte Energie liefert. Schwefelwasserstoff reagiert mit dem freigesetzten zweiwertigen Eisen (Fe2+) zu einem schwarzen Produkt (Eisensulfid), in das sich mit Carbonat aus dem Wasser vermischen und Krusten bilden kann.
Formen der Korrosion am Beispiel eines mit Wasser gefüllten Eisenrohres an der Bodenoberfläche. A: Bei der Korrosion an der Luft, d.h. bei dem bekannten Rosten, reagieren Elektronen aus dem metallischen Eisen (Fe) mit Sauerstoff (O2) und führen unter Beteiligung von Wasser (H2O) zu Hydroxyl-Ionen (HO-). Diese bilden mit dem freigesetzten zweiwertigen Eisen (Fe2+) unter weiterer Mitwirkung von Sauerstoff Rost, ein kompliziert aufgebautes wasserhaltiges Oxid des dreiwertigen Eisens. Soweit bekannt, handelt es sich um einen rein chemischen Vorgang. B: Im Gegensatz dazu wirken bei der Korrosion unter Ausschluß von Luft (bevorzugt am Boden des Rohres, wo sich Schwebstoffe ablagern) Bakterien (rot) mit, die ohne Sauerstoff leben. Deshalb spricht man von anaerober Biokorrosion. Am wichtigsten sind sulfatreduzierende Bakterien. Auf eine noch nicht in allen Details geklärte Weise dienen die Elektronen aus dem Eisen zur Reduktion von Sulfat zu Schwefelwasserstoff (H2S), was den Bakterien die für Ihr Wachstum benötigte Energie liefert. Schwefelwasserstoff reagiert mit dem freigesetzten zweiwertigen Eisen (Fe2+) zu einem schwarzen Produkt (Eisensulfid), in das sich mit Carbonat aus dem Wasser vermischen und Krusten bilden kann.
Jetzt wurden neuartige Bakterien entdeckt, die Eisen deutlich schneller als bisher bekannte Arten korrodieren, aber dennoch bislang offensichtlich übersehen worden sind. Experimente sprechen dafür, daß diese Bakterien auf eine noch ungeklärte Weise, aber auf jeden Fall im engen Kontakt mit dem Eisen diesem Elektronen entziehen, und Elektronenentzug aus einem Metall heißt, daß dieses korrodiert.
Mit der ersten Herstellung von Eisen vor vermutlich fünftausend Jahren wurde der Menschheit das auch heute noch wichtigste Gebrauchsmetall beschert. Eisen, besonders in Form von Stählen, ist fest, elastisch, gut zu verarbeiten, härtbar und zudem preiswert. Eisen hat nur einen gravierenden Nachteil: Ohne Schutzanstrich oder ohne Legierung mit anderen, teureren Metallen rostet es, d.h. der Sauerstoff der Luft oxidiert das feste metallische Eisen in nasser Umgebung fortschreitend zu bröseligen, wasserhaltigen Oxiden, wobei - chemisch gesehen - das nullwertige Metall dreiwertig positiv wird. Doch auch unter Ausschluß von Sauerstoff ist Eisen nicht beliebig beständig, sondern wird von Wasser allein angegriffen; dabei entstehen flockige Formen des zweiwertig positiven Eisens und Wasserstoffgas. Zum Glück ist diese Korrosion unter Luftausschluß - im Vergleich zum Rosten an der Luft - sehr langsam. Deshalb hat man auch lange Zeit z.B. für Heizungsrohre normales Eisen verwendet. Solange sie innen mit Wasser gefüllt und luftfrei blieben, trat meist über Jahrzehnte kein nennenswerter Korrosionsschaden auf.
Mit der ersten Herstellung von Eisen vor vermutlich fünftausend Jahren wurde der Menschheit das auch heute noch wichtigste Gebrauchsmetall beschert. Eisen, besonders in Form von Stählen, ist fest, elastisch, gut zu verarbeiten, härtbar und zudem preiswert. Eisen hat nur einen gravierenden Nachteil: Ohne Schutzanstrich oder ohne Legierung mit anderen, teureren Metallen rostet es, d.h. der Sauerstoff der Luft oxidiert das feste metallische Eisen in nasser Umgebung fortschreitend zu bröseligen, wasserhaltigen Oxiden, wobei - chemisch gesehen - das nullwertige Metall dreiwertig positiv wird. Doch auch unter Ausschluß von Sauerstoff ist Eisen nicht beliebig beständig, sondern wird von Wasser allein angegriffen; dabei entstehen flockige Formen des zweiwertig positiven Eisens und Wasserstoffgas. Zum Glück ist diese Korrosion unter Luftausschluß - im Vergleich zum Rosten an der Luft - sehr langsam. Deshalb hat man auch lange Zeit z.B. für Heizungsrohre normales Eisen verwendet. Solange sie innen mit Wasser gefüllt und luftfrei blieben, trat meist über Jahrzehnte kein nennenswerter Korrosionsschaden auf.
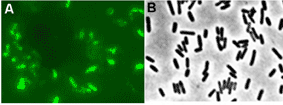
Abbildung 2
Mikroskopische Aufnahme neuartiger sulfatreduzierender Bakterien, die Eisen korrodieren. A: Bakterienzellen direkt von korrodierendem Eisen, die chemisch fixiert und mit einem molekularbiologischen Nachweisverfahren, einer fluoreszierenden DNA-Sonde, unter dem Mikroskop zum Leuchten gebracht wurden. B: Dieselbe Bakterienart, jedoch im lebenden Zustand in einem künstlichen Medium zum Züchten größerer Zellmengen für biochemische Analysen.
Mikroskopische Aufnahme neuartiger sulfatreduzierender Bakterien, die Eisen korrodieren. A: Bakterienzellen direkt von korrodierendem Eisen, die chemisch fixiert und mit einem molekularbiologischen Nachweisverfahren, einer fluoreszierenden DNA-Sonde, unter dem Mikroskop zum Leuchten gebracht wurden. B: Dieselbe Bakterienart, jedoch im lebenden Zustand in einem künstlichen Medium zum Züchten größerer Zellmengen für biochemische Analysen.
Abbildung 3:
Deutlich ist die Korrosion durch die neu entdeckten Sulfat reduzierenden Bakterien sichtbar.
Deutlich ist die Korrosion durch die neu entdeckten Sulfat reduzierenden Bakterien sichtbar.
Bei der Auflösung des Eisens, ob mit oder ohne Sauerstoff, handelt es sich um sogenannte elektrochemische Prozesse, d.h. die chemischen Reaktionen sind mit dem Fließen elektrischer Ströme verbunden, etwa wie in einer kurzgeschlossenen Batterie. Da mag es zunächst überraschen, daß auch Mikroorganismen, also kleinste einzellige Lebewesen, bei der Eisenkorrosion ein Rolle spielen können. Tatsächlich weiß man aber schon seit mehr als siebzig Jahren, daß die sonst erstaunlich lange Haltbarkeit von Eisen in luftfreiem Wasser durch bestimmte Bakterien dramatisch verkürzt werden kann. Überhaupt verfügen diverse Mikroorganismen-Arten über Mechanismen, etliche harte Materialien wie Kalksandstein oder die Substanz unserer Zähne aufzulösen. Während die Auflösung letzterer Materialien relativ einfach allein durch Einwirkung ohne Beteiligung von elektrischen Strömen erklärt werden kann, ist die Auflösung von Eisen durch Mikroorganismen ein komplexer elektrochemischer Prozeß. Dieser macht sich nicht so sehr als flächige Korrosion sondern eher als Lochfraß bemerkbar, z.B. in Pipelines, und kann kostspielige Schäden verursachen. Hauptverursacher sind sogenannte sulfatreduzierende Bakterien. Sie sind überall in Gewässern verbreitet und können aber weder Mensch noch Tier noch Pflanze infizieren. Bei diesen Bakterien gibt es genau genommen gleich zwei Korrosionsmechanismen:
Der eine Korrosionsmechanismus ist offensichtlich: Diese Bakterien leben davon, daß sie, wie der Name sagt, das harmlose, in natürlichen Wässern häufige Sulfat (in ungelöster Form z.B. als Gips bekannt) zu Schwefelwasserstoff reduzieren, einer faulig riechenden, aggressiven und giftigen Substanz. Bei Arbeiten in schlecht belüfteten Abwassersystemen wird dieser Schwefelwasserstoff zu Recht gefürchtet. Als Reduktionsmittel für die Umwandlung von Sulfat in Schwefelwasserstoff dienen diesen Bakterien Produkte aus natürlichen Verwesungsprozessen, z.B. im häuslichen Abwässer, die dabei zu Kohlendioxid oxidiert werden. Der Schwefelwasserstoff greift dann das Eisen an, wobei sich pechschwarze Reaktionsprodukte bilden.
Der andere Korrosionsmechanismus ist weniger klar, obwohl schon um 1930 Modellvorstellungen dazu entwickelt wurden. Sulfatreduzierende Bakterien verwenden nämlich auch Wasserstoffgas, um Sulfat zu reduzieren. Weil sich auf Eisen in Wasser langsam Wasserstoffgas, oft als "kathodischer Wasserstoff" bezeichnet, als Produkt bildet, wurde lange angenommen, daß dessen Verbrauch durch die sulfatreduzierenden Bakterien die Auflösung des Metalls im Wasser beschleunigt. Ein solches Prinzip ist aus der Chemie wohlbekannt: Wird das Produkt aus einer antriebsschwachen chemischen Reaktion in einer zweiten, sich anschließenden Reaktion gleich weiter verbraucht, kommt die erste Reaktion auf Touren. Im Falle der Biokorrosion von Eisen ist jedoch diese verlockende Vorstellung offensichtlich nicht haltbar. Am Max-Planck-Institut für marine Mikrobiologie, Bremen, wurden in Zusammenarbeit mit der Amtlichen Materialprüfungsanstalt Bremen und dem Max-Planck-Institut für Eisenforschung, Düsseldorf, Bakterien entdeckt, welche Eisen deutlich schneller korrodieren, als es durch Verbrauch von Wasserstoffgas jemals möglich wäre. Alles spricht dafür, daß sie im engen Kontakt mit dem Eisen diesem direkt Elektronen entziehen und so gewissermaßen den Umweg über "kathodischen Wasserstoff" umgehen. Und Elektronenentzug aus Eisen bedeutet Korrosion. Wie ein Elektronenfluß über die winzig kurze, aber dennoch über eine "Stromleitung" zu überbrückende Strecke zwischen Eisen und Bakterienzellen zustande kommt, ist noch unbekannt. Versteht man erst einmal deren Biochemie, wird man auch gezielter forschen können, um Schutzmaßnahmen zu entwickeln.
Man darf annehmen, daß die neu entdeckten Bakterien eine wichtige, aber bisher übersehene Rolle bei der biologischen Eisenzerstörung spielen. Das Ausgangsexperiment für das Aufspüren dieser Bakterien war recht einfach: Zunächst wurden kleine Eisenstücke in Meeresschlamm in sauerstofffreien Flaschen gesteckt. Nach mehreren Wochen wurden die Bakterien, die auf dem allmählich dahinschwindenden Metall wuchsen, analysiert. Die eigentlich korrosiven Arten erwiesen sich dabei allerdings als schwieriger zu isolieren als begleitende Arten. Isolierung und experimentelle Untersuchung in Reinkulturen sind, wie schon zu Robert Kochs Zeiten, für eine kausale Analyse der Wirkung von Bakterien unabdingbar. Solche züchterischen Verfahren gehen heute Hand in Hand mit verfeinerten molekularbiologischen und mikroskopischen Analysen. Ohne diese Methodenkombination könnten die sehr diversen Bakterien als sehr kleine Organismen mit nur wenigen Tausendstel Millimetern Durchmesser und einfachen Zellformen kaum voneinander unterschieden und untersucht werden.
Der eine Korrosionsmechanismus ist offensichtlich: Diese Bakterien leben davon, daß sie, wie der Name sagt, das harmlose, in natürlichen Wässern häufige Sulfat (in ungelöster Form z.B. als Gips bekannt) zu Schwefelwasserstoff reduzieren, einer faulig riechenden, aggressiven und giftigen Substanz. Bei Arbeiten in schlecht belüfteten Abwassersystemen wird dieser Schwefelwasserstoff zu Recht gefürchtet. Als Reduktionsmittel für die Umwandlung von Sulfat in Schwefelwasserstoff dienen diesen Bakterien Produkte aus natürlichen Verwesungsprozessen, z.B. im häuslichen Abwässer, die dabei zu Kohlendioxid oxidiert werden. Der Schwefelwasserstoff greift dann das Eisen an, wobei sich pechschwarze Reaktionsprodukte bilden.
Der andere Korrosionsmechanismus ist weniger klar, obwohl schon um 1930 Modellvorstellungen dazu entwickelt wurden. Sulfatreduzierende Bakterien verwenden nämlich auch Wasserstoffgas, um Sulfat zu reduzieren. Weil sich auf Eisen in Wasser langsam Wasserstoffgas, oft als "kathodischer Wasserstoff" bezeichnet, als Produkt bildet, wurde lange angenommen, daß dessen Verbrauch durch die sulfatreduzierenden Bakterien die Auflösung des Metalls im Wasser beschleunigt. Ein solches Prinzip ist aus der Chemie wohlbekannt: Wird das Produkt aus einer antriebsschwachen chemischen Reaktion in einer zweiten, sich anschließenden Reaktion gleich weiter verbraucht, kommt die erste Reaktion auf Touren. Im Falle der Biokorrosion von Eisen ist jedoch diese verlockende Vorstellung offensichtlich nicht haltbar. Am Max-Planck-Institut für marine Mikrobiologie, Bremen, wurden in Zusammenarbeit mit der Amtlichen Materialprüfungsanstalt Bremen und dem Max-Planck-Institut für Eisenforschung, Düsseldorf, Bakterien entdeckt, welche Eisen deutlich schneller korrodieren, als es durch Verbrauch von Wasserstoffgas jemals möglich wäre. Alles spricht dafür, daß sie im engen Kontakt mit dem Eisen diesem direkt Elektronen entziehen und so gewissermaßen den Umweg über "kathodischen Wasserstoff" umgehen. Und Elektronenentzug aus Eisen bedeutet Korrosion. Wie ein Elektronenfluß über die winzig kurze, aber dennoch über eine "Stromleitung" zu überbrückende Strecke zwischen Eisen und Bakterienzellen zustande kommt, ist noch unbekannt. Versteht man erst einmal deren Biochemie, wird man auch gezielter forschen können, um Schutzmaßnahmen zu entwickeln.
Man darf annehmen, daß die neu entdeckten Bakterien eine wichtige, aber bisher übersehene Rolle bei der biologischen Eisenzerstörung spielen. Das Ausgangsexperiment für das Aufspüren dieser Bakterien war recht einfach: Zunächst wurden kleine Eisenstücke in Meeresschlamm in sauerstofffreien Flaschen gesteckt. Nach mehreren Wochen wurden die Bakterien, die auf dem allmählich dahinschwindenden Metall wuchsen, analysiert. Die eigentlich korrosiven Arten erwiesen sich dabei allerdings als schwieriger zu isolieren als begleitende Arten. Isolierung und experimentelle Untersuchung in Reinkulturen sind, wie schon zu Robert Kochs Zeiten, für eine kausale Analyse der Wirkung von Bakterien unabdingbar. Solche züchterischen Verfahren gehen heute Hand in Hand mit verfeinerten molekularbiologischen und mikroskopischen Analysen. Ohne diese Methodenkombination könnten die sehr diversen Bakterien als sehr kleine Organismen mit nur wenigen Tausendstel Millimetern Durchmesser und einfachen Zellformen kaum voneinander unterschieden und untersucht werden.
Rückfragen an
Max-Planck-Institut für marine Mikrobiologie, Bremen, Celsiusstr. 1, 28359 Bremen
(www.mpi-bremen.de)
Prof. Dr. Friedrich Widdel (Fwiddel@mpi-bremen.de) 0421-2028-702
Frau Dr. Hang T. Dinh (hdinh@mpi-bremen.de) 0421-2028-744
Pressesprecher Dr. Manfred Schlösser, 0421-2028-704, [Bitte aktivieren Sie Javascript]
Amtliche Materialprüfungsanstalt Bremen, Paul-Feller-Str. 1, D-28199 Bremen
(www.mpa-bremen.de)
Dr. Jan Küver, 0421-5370870, [Bitte aktivieren Sie Javascript]
Max-Planck-Institut für Eisenforschung, Max-Planck-Str. 1, 40237 Düsseldorf (www.mpie.de)
Dr. Achim W. Hassel und Prof. Dr. Martin Stratmann
Titel der Originalarbeit
Hang T. Dinh, Jan Küver, Marc Mussmann, Achim W. Hassel, Martin Stratmann, Friedrich Widdel, “Iron corrosion by novel anaerobic microorganisms”. Nature 427, 829-832, 26. Februar 2004.
(www.mpi-bremen.de)
Prof. Dr. Friedrich Widdel (Fwiddel@mpi-bremen.de) 0421-2028-702
Frau Dr. Hang T. Dinh (hdinh@mpi-bremen.de) 0421-2028-744
Pressesprecher Dr. Manfred Schlösser, 0421-2028-704, [Bitte aktivieren Sie Javascript]
Amtliche Materialprüfungsanstalt Bremen, Paul-Feller-Str. 1, D-28199 Bremen
(www.mpa-bremen.de)
Dr. Jan Küver, 0421-5370870, [Bitte aktivieren Sie Javascript]
Max-Planck-Institut für Eisenforschung, Max-Planck-Str. 1, 40237 Düsseldorf (www.mpie.de)
Dr. Achim W. Hassel und Prof. Dr. Martin Stratmann
Titel der Originalarbeit
Hang T. Dinh, Jan Küver, Marc Mussmann, Achim W. Hassel, Martin Stratmann, Friedrich Widdel, “Iron corrosion by novel anaerobic microorganisms”. Nature 427, 829-832, 26. Februar 2004.