Seitenpfad:
- Presse
- Wie Bakterien lernen, ihre Feinde zu...
Wie Bakterien lernen, ihre Feinde zu lieben
01.06.2016
Mit Mikroben auf Zeitreise
Möchte man wissen, wie unsere urzeitlichen Vorfahren aussahen, hilft ein Blick durchs Mikroskop. Mit etwas Glück entdeckt man sie: kleine, einzellige Eukaryoten - auch Protisten genannt. Protisten sind direkte Verwandte von Tieren, Pflanzen und Pilzen. Doch diese Einzeller haben sich im Laufe der Evolution kaum weiterentwickelt. Viele Protisten machen noch heute genau das, was schon ihre Vorfahren vor Urzeiten taten: Sie jagen und verspeisen andere Mikroorganismen. Zu diesen räuberischen Protisten zählen beispielsweise die Breviaten. Diese Gruppe tauchte das erste mal vor etwa einer Milliarde Jahren auf - zu einer Zeit, in der in den Tiefen des Ozeans noch kaum Sauerstoff vorhanden war.
Als Anpassung an den Sauerstoffmangel nutzen Breviaten einen recht einfachen Stoffwechsel: die sogenannte Fermentation, eine Form der Gärung. Dieser Prozess liefert deutlich weniger Energie als beispielsweise die bakterielle Nitratatmung. Wäre es da nicht sinnvoll für die Breviaten, mit Bakterien zusammenzuarbeiten um ihren Stoffwechsel effizienter zu machen? Klingt logisch. Doch es gibt ein Problem: Bakterien sind die bevorzugte Beute von Breviaten.
Eine internationale Forschergruppe um Emmo Hamann, Harald Gruber-Vodicka und Marc Strous wollte trotzdem wissen, ob solche Partnerschaften möglich sind – und liefert spannende Antworten, die nun in der Fachzeitschrift Nature veröffentlicht wurden.
Möchte man wissen, wie unsere urzeitlichen Vorfahren aussahen, hilft ein Blick durchs Mikroskop. Mit etwas Glück entdeckt man sie: kleine, einzellige Eukaryoten - auch Protisten genannt. Protisten sind direkte Verwandte von Tieren, Pflanzen und Pilzen. Doch diese Einzeller haben sich im Laufe der Evolution kaum weiterentwickelt. Viele Protisten machen noch heute genau das, was schon ihre Vorfahren vor Urzeiten taten: Sie jagen und verspeisen andere Mikroorganismen. Zu diesen räuberischen Protisten zählen beispielsweise die Breviaten. Diese Gruppe tauchte das erste mal vor etwa einer Milliarde Jahren auf - zu einer Zeit, in der in den Tiefen des Ozeans noch kaum Sauerstoff vorhanden war.
Als Anpassung an den Sauerstoffmangel nutzen Breviaten einen recht einfachen Stoffwechsel: die sogenannte Fermentation, eine Form der Gärung. Dieser Prozess liefert deutlich weniger Energie als beispielsweise die bakterielle Nitratatmung. Wäre es da nicht sinnvoll für die Breviaten, mit Bakterien zusammenzuarbeiten um ihren Stoffwechsel effizienter zu machen? Klingt logisch. Doch es gibt ein Problem: Bakterien sind die bevorzugte Beute von Breviaten.
Eine internationale Forschergruppe um Emmo Hamann, Harald Gruber-Vodicka und Marc Strous wollte trotzdem wissen, ob solche Partnerschaften möglich sind – und liefert spannende Antworten, die nun in der Fachzeitschrift Nature veröffentlicht wurden.
Breviaten und Arcobacter - ziemlich beste Freunde
Zunächst fuhren Hamann und seine Kollegen ins Wattenmeer, um dort Sedimentproben, also Proben des Meeresbodens, zu sammeln. Mit etwas Geduld und dem richtigen Nährstoffcocktail gelang es ihnen, anschließend im Labor sowohl einen Breviaten als auch nitratatmende Bakterien aus diesen Proben zum Wachsen zu bringen. „Der Breviat war eine bislang unbekannt Art”, berichtet Hamann. “Wir gaben ihm den Namen Lenisia limosa.“ Bei den Nitratatmern handelte es sich um Bakterien der Gattung Arcobacter. Arcobacter hat einen schlechten Ruf. Einige Vertreter besiedeln die Darmschleimhaut von Mensch und Tier und verursachen unangenehme Infektionen. Nun haben Breviaten zwar keinen Darm, aber dennoch ließen sich die Bakterien direkt auf deren Oberfläche nieder.
„Die interessante Frage war nun: Warum besiedelt ein Bakterium, dessen Verwandte normalerweise mit Tieren zusammenleben, einen räuberischen Breviaten?“ erklärt Harald Gruber-Vodicka vom Bremer Max-Planck-Institut. Um diese Frage zu beantworten, warfen die Forscher einen genauen Blick auf die Stoffwechsel beider Organismen. Sie erlebten eine Überraschung: Die beiden lebten freundschaftlich zusammen. Arcobacter half sogar, das Wachstum des Breviaten anzukurbeln. „Lenisia wuchs etwa doppelt so gut in Anwesenheit von Arcobacter”, so Gruber-Vodicka.
„Die interessante Frage war nun: Warum besiedelt ein Bakterium, dessen Verwandte normalerweise mit Tieren zusammenleben, einen räuberischen Breviaten?“ erklärt Harald Gruber-Vodicka vom Bremer Max-Planck-Institut. Um diese Frage zu beantworten, warfen die Forscher einen genauen Blick auf die Stoffwechsel beider Organismen. Sie erlebten eine Überraschung: Die beiden lebten freundschaftlich zusammen. Arcobacter half sogar, das Wachstum des Breviaten anzukurbeln. „Lenisia wuchs etwa doppelt so gut in Anwesenheit von Arcobacter”, so Gruber-Vodicka.

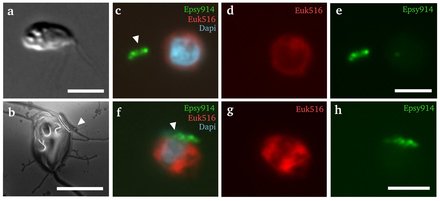
Lenisia limosa ist ein einzelliger Räuber, der sich mithilfe zweier Geißeln langsam taumelnd fortbewegen kann (Bilder a und b). Bilder c-h: Bakterienzellen der Gattung Arcobacter (grün) ließen sich auf der Oberfläche von L. limosa (rot, blau gefärbt der Zellkern) nieder. Maßstabsbalken = 5 Mikrometer.
Ein Blick hinter die Kulissen
„Mit Hilfe von Wachstumsexperimenten und Proteinanalysen konnten wir genau nachvollziehen, was passiert, wenn die Bakterien auf die Breviaten treffen”, erläutert Hamann. “Die Breviaten geben beim Stoffwechsel Wasserstoff ab. Dieser Wasserstoff wird dann von den Bakterien entfernt. Beim Zusammentreffen der beiden Organismen werden ihre Stoffwechsel sozusagen kurzgeschlossen.” Für die Breviaten erleichtert das die Fermentation und sorgt dafür, dass sie deutlich mehr Energie gewinnen. “Wir fanden mehrere Enzyme, die für den Energiegewinn notwendig waren. Diese Enzyme wurden nur dann gebildet, wenn Arcobacter in der Nähe war.”
Beide Organismen können auch alleine leben, die Symbiose ist also nicht zwingend. Ein großer Vorteil für das Bakterium liegt allerdings darin, dass es den freiwerdenden Wasserstoff zur Nitratatmung nutzen kann. “Die beobachtete Verbindung ist also eine klare Win-win-Situation”, fasst Hamann zusammen.
Beide Organismen können auch alleine leben, die Symbiose ist also nicht zwingend. Ein großer Vorteil für das Bakterium liegt allerdings darin, dass es den freiwerdenden Wasserstoff zur Nitratatmung nutzen kann. “Die beobachtete Verbindung ist also eine klare Win-win-Situation”, fasst Hamann zusammen.
Wie finden die Partner zusammen?
Die Forscher fanden erstaunliche Gemeinsamkeiten mit Fällen, in denen Bakterien als Parasiten in Tieren leben. „Um ihren Wirt zu besiedeln, nutzen viele Bakterien sogenannte Virulenzfaktoren“, sagt Gruber-Vodicka. Das sind Proteine, die dabei helfen, sich an die Oberfläche der Wirtszelle zu heften. „Und genau diese Proteine waren auch in der Symbiose zwischen Breviaten und Arcobacter aktiv. Virulenzfaktoren sind also nicht nur bei Krankheiten wichtig, sondern ermöglichen scheinbar auch vorteilhafte Partnerschaften zwischen räuberischen Protisten und Bakterien. Wenn sich diese Vermutung bestätigt, wirft das ein völlig neues Licht auf die Rolle von Virulenzfaktoren.“
„Es wäre möglich, dass Bakterien ihre Fähigkeit zur Symbiose sehr früh in der Evolution an Protisten entwickelt haben”, erklärt Marc Strous, der mittlerweile an der Universität Calgary arbeitet. “An diesen Partnern lernten sie, wie man das Gewebe eines Wirts erkennt und sich dann auf ihm fortpflanzt. Später haben sie dann Tiere besiedelt.“ Doch um diese Vermutung zu bestätigen, muss weiter geforscht werden. „Wir suchen nach weiteren ähnlichen Symbiosen, um diesen Fragen nachzugehen", so Hamann. Den Forschern des Max-Planck-Instituts und der Universität Calgary stehen also spannende Zeiten bevor. “Und wer weiß? Vielleicht werden Protisten dann bald als kleine Zeitmaschinen genutzt um einen Blick auf die Ursprünge heutiger Symbiosen zu werfen.”
„Es wäre möglich, dass Bakterien ihre Fähigkeit zur Symbiose sehr früh in der Evolution an Protisten entwickelt haben”, erklärt Marc Strous, der mittlerweile an der Universität Calgary arbeitet. “An diesen Partnern lernten sie, wie man das Gewebe eines Wirts erkennt und sich dann auf ihm fortpflanzt. Später haben sie dann Tiere besiedelt.“ Doch um diese Vermutung zu bestätigen, muss weiter geforscht werden. „Wir suchen nach weiteren ähnlichen Symbiosen, um diesen Fragen nachzugehen", so Hamann. Den Forschern des Max-Planck-Instituts und der Universität Calgary stehen also spannende Zeiten bevor. “Und wer weiß? Vielleicht werden Protisten dann bald als kleine Zeitmaschinen genutzt um einen Blick auf die Ursprünge heutiger Symbiosen zu werfen.”


ist im Boden des Wattenmeeres der
Sauerstoff aufgebraucht und die
anaeroben Organismen übernehmen
die Herrschaft.
Originalveröffentlichung
Environmental Breviatea harbor mutualistic Arcobacter epibionts
Emmo Hamann, Harald Gruber-Vodicka, Manuel Kleiner, Halina E. Tegetmeyer, Dietmar Riedel, Sten Littmann, Jianwei Chen, Jana Milucka, Bernhard Viehweger, Kevin W. Becker, Xiaoli Dong, Courtney W. Stairs, Kai-Uwe Hinrichs, Matthew W. Brown, Andrew J. Roger und Marc Strous. Nature.
DOI: 10.1038/nature18297
Beteiligte Institute
Max-Planck-Institut für Marine Mikrobiologie, Bremen
Max-Planck-Institut für Biophysikalische Chemie, Göttingen
Universität Calgary, Kanada
MARUM, Universität Bremen
Mississippi State University, USA
South St Dalhousie University, Halifax, Kanada
Rückfragen an
Emmo Hamann
E-Mail: [Bitte aktivieren Sie Javascript]
oder an die Pressestelle
Dr. Fanni Aspetsberger
Dr. Manfred Schlösser
Telefon: 0421 2028 – 947 oder 704
E-Mail: [Bitte aktivieren Sie Javascript]
Environmental Breviatea harbor mutualistic Arcobacter epibionts
Emmo Hamann, Harald Gruber-Vodicka, Manuel Kleiner, Halina E. Tegetmeyer, Dietmar Riedel, Sten Littmann, Jianwei Chen, Jana Milucka, Bernhard Viehweger, Kevin W. Becker, Xiaoli Dong, Courtney W. Stairs, Kai-Uwe Hinrichs, Matthew W. Brown, Andrew J. Roger und Marc Strous. Nature.
DOI: 10.1038/nature18297
Beteiligte Institute
Max-Planck-Institut für Marine Mikrobiologie, Bremen
Max-Planck-Institut für Biophysikalische Chemie, Göttingen
Universität Calgary, Kanada
MARUM, Universität Bremen
Mississippi State University, USA
South St Dalhousie University, Halifax, Kanada
Rückfragen an
Emmo Hamann
E-Mail: [Bitte aktivieren Sie Javascript]
oder an die Pressestelle
Dr. Fanni Aspetsberger
Dr. Manfred Schlösser
Telefon: 0421 2028 – 947 oder 704
E-Mail: [Bitte aktivieren Sie Javascript]