- Presse
- Rätsel um den mikrobiellen Butanabb...
Rätsel um den mikrobiellen Butanabbau geknackt
Gasförmige Kohlenwasserstoffe im Meeresboden
Man braucht nur einen gasförmigen Kohlenwasserstoff, Sauerstoff und eine Zündquelle: Ob im Gasherd, im Feuerzeug, oder im Campingkocher – Erdgas ist dank seiner hohen Energiedichte ein begehrter Energieträger. Erdgas ist im Meeresboden häufig anzutreffen. In den oberen Schichten des Meeresbodens entsteht vorrangig Methan, dies als Produkt sogenannter methanogener Archaeen. Die wirtschaftlich interessanten Gasvorkommen befinden sich jedoch in viel tieferen Schichten des Meeresbodens. Dort wird organisches Material – also Reste abgestorbener Pflanzen, Tiere und Mikroorganismen – unter hohen Temperaturen rein chemisch in gasförmige Kohlenwasserstoffe und Erdöl umgewandelt. Dieses Erdgas enthält auch einen großen Anteil kurzkettiger Kohlenwasserstoffe wie Propan und Butan, welche unter leichtem Druck schon flüssig werden. Wenn dieses Erdgas im Meeresboden in belebte Sedimentschichten aufsteigt, können es Mikroorganismen als Energiequelle nutzen. Direkt an der Oberfläche der Sedimente verbrauchen Bakterien es mit dem chemisch sehr aktiven Sauerstoff. Ist kein Sauerstoff mehr vorhanden, finden andere Mikroorganismen alternative Wege um das Erdgas für sich zu nutzen.
Wie Mikroorganismen ohne Sauerstoff Erdgas als Energiequelle nutzen können
Unterschiedliche Mikroorganismen haben sich auf die Nutzung verschiedener Kohlenwasserstoffe spezialisiert. Die Anaerobe Oxidation von Methan (AOM) ist seit einigen Jahren bekannt. Methan wird ohne Sauerstoff in Konsortien von Archaeen und Bakterien abgebaut. Die Methan oxidierenden (methanotrophen) Archaeen nutzen dabei dieselben Enzyme wie ihre Methan erzeugenden Verwandten, allerdings in umgekehrter Richtung. Das molekulare Stemmeisen um Methan zu aktivieren, trägt den Namen Methyl-Coenzym-M-Reduktase (MCR), welches die ANME Archaeen in großen Mengen herstellen. In diesem Enzym wird das Methanmolekül mit der Schwefelverbindung Coenzym M verknüpft und in weiteren Reaktionen komplett zu Kohlendioxid (CO2) oxidiert. Anstelle Sauerstoffs dient als Oxidationsmittel Sulfat, das in den Sulfat reduzierenden Partnerbakterien zu Schwefelwasserstoff umgewandelt wird. Als Abbauer kurzkettiger Kohlenwasserstoffe mit drei oder mehr Kohlenstoffatomen sind bisher nur Bakterien beschrieben worden, die ihr Substrat komplett oxidieren und selbständig an die Reduktion von Sulfat koppeln.
Der neue Abbauweg für Butan basiert auf den Prinzipen des Methanabbaus
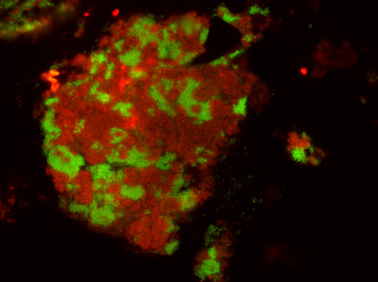
Nun haben Forscher in Sedimenten von den heißen Quellen des Guaymas Beckens neue Konsortien aus Archaeen und Partnerbakterien entdeckt, die mit Butan als einziger Nahrungsquelle angereichert werden konnten und dabei Sulfid produzieren. In dem Genom der Archaeen fanden sie nicht die bekannten Gensequenzen des anaeroben Butanabbaus. „Stattdessen fanden wir verschiedene Gensequenzen, die entfernt mit den MCR-Genen der methanogenen und methanotrophen Archaeen verwandt sind. Konnten die in diesen Genen verschlüsselten Enzyme wirklich auch das Butan angreifen? Und welche weiteren Schritte wären danach für den kompletten Abbau von Butan notwendig?“ fragte sich Rafael Laso-Pérez, Doktorand am Max-Planck-Institut und Erstautor der jetzt in Nature veröffentlichten Studie. Einen entscheidenden Beweis für diese ungewöhnliche chemische Aktivierung wurde über den Nachweis des chemischen Produkts geliefert: Sollte die Butan-Aktivierung ähnlich dem anaeroben Methanabbau verlaufen, dann müsste das Produkt Butyl-Coenzym M nachweisbar sein. Dies gelang UFZ-Mikrobiologe Dr. Florin Musat und seinen Kolleginnen und Kollegen mithilfe eines ultra-hochauflösenden Massenspektrometers am UFZ in Leipzig.
„Methyl-Coenzym-M-Reduktasen wurden bisher als typische Vertreter Methan-spezifischer Enzyme bekannt. Mit dem Nachweis von Butyl-Coenzym M konnten wir klar zeigen, dass spezielle Methyl-Coenzym-M-Reduktasen nicht nur Methan sondern auch größere Kohlenwasserstoffe aktivieren“, erläutert Florin Musat.

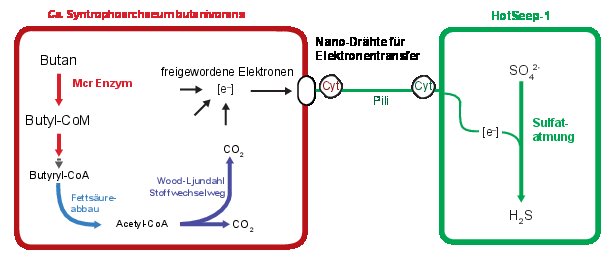
Auch der weitere Abbau von Butyl-Coenzym M konnte aufgeklärt werden. Er verläuft teils über bekannte Mechanismen der Methanogenese und der Methanoxidation. Zusätzlich konnten Abbauwege für Buttersäure (Butyrat) und Essigsäure identifiziert werden. Gemeinsam ermöglichen diese Abbauwege die komplette Oxidation von Butan in den Archaeen. „Dabei wurden viele Lösungen von anderen Organismen implementiert. Man spricht hier von einem horizontalen Gentransfer“ erläutert Dr. Gunter Wegener, Initiator der Studie: „Es war ein langer Weg zur Lösung dieses Rätsels und viele Forscher waren daran beteiligt.“
Wie ihre Methan oxidierenden Verwandten sind diese Butanoxidierer allerdings nicht in der Lage, die bei der Oxidation ihres Substrats freiwerdenden Elektronen selbst auf einen Elektronenakzeptor zu übertragen. Genau wie in AOM-Konsortien sind sie dabei auf Partnerbakterien angewiesen.
„Auf elektronenmikroskopischen Aufnahmen der Butankultur sind winzige Proteinverbindung zwischen Archaeen und Bakterien zu sehen. Durch diese Mikro-Drähte fließen die Elektronen. Aufgrund seiner Eigenschaften als mit einem Partnerbakterium lebenden Butanfresser haben wir den Archaeen den Namen Syntrophoarchaeum butanivorans gegeben. Ein syntropher Austausch von Elektronen über Proteinverbindungen ist damit in einem weiteren Organismus gezeigt“, erläutert Dr. Gunter Wegener und ergänzt:„Wir blicken bei diesen Konsortien vermutlich tief in die Vergangenheit, denn eine Aktivierung von Butan über den Coenzym M-Mechanismus und die Aufgabenteilung in zwei Organismen scheint die ursprüngliche Lösung der Natur zu sein“.
Links unten: Dr. Florin Musat am ultrahochauflösenden Massenspektrometer im UFZ. Dieses Gerät ist wichtiger Bestandteil der Technologieplattform ProVIS, die Forschern weltweit die Möglichkeit zu mikroskopischen Einblicken in Zellen und ihre räumliche Anordnung bietet. (UFZ / André Künzelmann).
Offene Fragen bleiben
Wo auf der Erde kommen diese gerade entdeckten Konsortien noch vor? Warum und unter welchen Bedingungen setzt sich diese Aufgabenteilung in Form von Konsortien zweier Organismen gegenüber einer Kopplung in einer Zelle durch? Gibt es andere Methyl-Coenzym-M-Reduktasen, die höherkettige Alkane aktivieren können? Diesen spannenden Fragen werden sich die Forscher am Max-Planck-Institut für Marine Mikrobiologie und dem Helmholtz-Zentrum für Umweltforschung (UFZ) zukünftig widmen.
Beteiligte Institute
Max-Planck-Institut für Marine Mikrobiologie, Bremen
MARUM, Zentrum für Marine Umweltwissenschaften, Universität Bremen
Max-Planck-Institut für Biophysikalische Chemie, Göttingen, Germany.
Alfred-Wegener-Institut, Helmholtz-Zentrum für Polar- und Meeresforschung, Bremerhaven
Centrum für Biotechnologie, Universität Bielefeld
Helmhotz Centre for Environmental Research – UFZ, Leipzig
Originalveröffentlichung
Thermophilic archaea activate butane via alkyl-CoM formation. Rafael Laso-Pérez, Gunter Wegener, Katrin Knittel, Friedrich Widdel, Katie J. Harding , Viola Krukenberg, Dimitri V. Meier, Michael Richter, Halina E. Tegetmeyer, Dietmar Riedel, Hans-Hermann Richnow, Lorenz Adrian, Thorsten Reemtsma, Oliver Lechtenfeld, Florin Musat. Nature, 2016 doi: 10.1038/nature20152
Rückfragen an
Rafael Laso-Perez, Max-Planck-Institut für Marine Mikrobiologie,
D-28359 Bremen, Telefon: 0421 2028 867, rlperez@mpi-bremen.de
Dr. Gunter Wegener, Max-Planck-Institut für Marine Mikrobiologie,
D-28359 Bremen, Telefon: 0421 2028 867, gwegener@mpi-bremen.de
Dr. Florin Musat, Helmholtz-Zentrum für Umweltforschung (UFZ) Leipzig,
D-04318 Leipzig, Telefon: 0341 235 1005, florin.musat@ufz.de
oder wenden Sie sich an die Presseabteilung des Max-Planck-instituts
Dr. Manfred Schlösser und Dr. Fanni Aspetsberger
presse@mpi-bremen.de 0421 2028 704