- Presse
- Pressemeldungen 2019
- Eine Brennstoffzelle in Bakterien
Eine Brennstoffzelle in Bakterien
Der biogeochemische Stickstoffkreislauf
Stickstoff – in Form von Stickstoffgas (N2) – macht circa 80 Prozent unserer Atmosphäre aus. Alle lebenden Organismen benötigen Stickstoff, der ein wichtiger Bestandteil essentieller Moleküle ist. Die in der Atmosphäre vorkommende Form kann jedoch von den meisten Organismen nicht direkt verwendet werden, sondern muss erst umgewandelt werden. Diese Umwandlung in verwertbare und reaktivere Formen von Stickstoff wird von einer Vielzahl an Bakterien durchgeführt, die so zum Stickstoffkreislauf beitragen.
Anammox-Bakterien – eine Abkürzung durch die Mitte
In den 1990ern entdeckten Wissenschaftler einen einzigartigen Prozess in Bakterien: die Anaerobe Ammonium-Oxidation (Anammox). „Heute gehen wir davon aus, dass durch diesen Prozess jährlich 30 bis 70 Prozent des Stickstoffs aus den Weltmeeren entfernt wird“, erklärt Thomas Barends, Forschungsgruppenleiter am Max-Planck-Institut (MPI) für medizinische Forschung in Heidelberg. In diesem Prozess wandeln Bakterien Nitrit und Ammonium in molekularen Stickstoff (N2) und Wasser um und gewinnen daraus Energie. Das Molekül Hydrazin entsteht in einem Zwischenschritt. Weil es sehr reaktiv ist, ist Hydrazin ein verbreiteter Raketentreibstoff. Die Verwendung durch Bakterien als Stoffwechsel-Treibstoff ist hingegen eher exotisch – und darüber hinaus auch sehr überraschend für lebende Organismen, denn Hydrazin ist sehr giftig. „Die Produktion und Oxidation von Hydrazin durch Anammox-Bakterien ist einzigartig“, sagt Boran Kartal vom Max-Planck-Institut für Marine Mikrobiologie in Bremen. „In früheren Studien haben wir die katalytischen und spektroskopischen Eigenschaften von Hydrazin-Dehydrogenase beschrieben. Jetzt haben unsere Kollegen vom MPI für medizinische Forschung in Heidelberg das Rätsel gelöst, wie die Hydrazinoxidation optimiert wird, indem die Häm-Gruppen in spezieller Art und Weise verdrahtet werden und damit die Übertragung der Elektronen vereinfachen.“
Die Forschungsgruppe und ihre Kollaborationspartner haben zuvor die Kristallstruktur der Enzyme Hydrazinsynthase und Hydroxylamin-Oxidoreductase beschrieben. Jetzt haben die Wissenschaftler einen weiteren Teil des Anammox-Puzzles gelöst, indem sie die Kristallstruktur der Hydrazin-Dehydrogenase beschrieben – jenem Enzym, das für die Umwandlung von toxischem Hydrazin zu harmlosem molekularem Stickstoff verantwortlich ist.
Vom giftigen Raketentreibstoff zum harmlosen Stickstoffgas – der Hydrazindehydrogenase(HDH)-Komplex
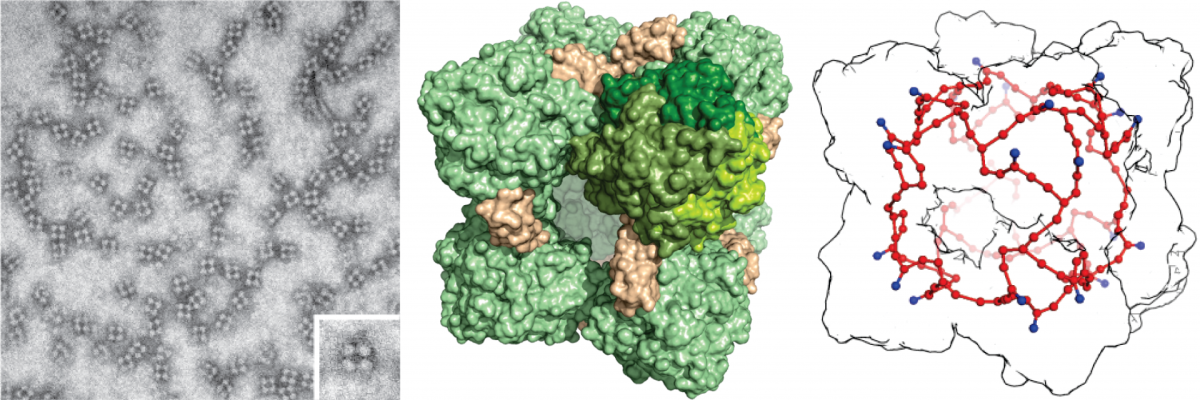
„Man könnte den HDH-Komplex mit einer Brennstoffzelle vergleichen, in deren Steckdose nur bestimmte Stecker passen“, beschreibt Thomas Barends die Struktur und den Mechanismus des HDH-Komplexes.
Der „Treibstoff“ Hydrazin gelangt durch einen Kanal an der Außenseite in den Proteinkomplex. Das Enzym katalysiert dann die Umwandlung von Hydrazin in Stickstoffgas (Oxidation). Während der Reaktion werden vier Elektronen frei, die auf ein beispiellos großes Netzwerk von 192 Häm-Gruppen übertragen werden. Die Elektronen können von dort in andere Teile des Bakteriums transportiert werden, vergleichbar mit dem Übertrag von Strom auf einen elektrischen Verbraucher. Dieser Verbraucher generiert dann Energie für die Zelle.
Animation: Struktur des HDH-Komplexes. Der Komplex hat die Form eines Würfels mit seitlichen Eingängen. Die Seitenlänge des Würfels beträgt etwa 15 Nanometer. Innerhalb des Proteinkomplexes (weiß) befindet sich das Netzwerk der Hämgruppen (rot). © Thomas Barends, Max-Planck-Institut für Medizinische Forschung
Die Lücken schließen
„Wir suchen nun nach dem Protein, das die Elektronen, die im Häm-Netzwerk des HDH-Komplexes gespeichert sind, aufnimmt“, erklärt Mohd Akram, Postdoktorand in der Forschungsgruppe von Thomas Barends und erster Autor der Veröffentlichung. Aus der Struktur lässt sich ableiten, dass vermutlich nur kleine Proteine in den Komplex eintreten können, um die Elektronen in einem kleinen Hohlraum im Inneren aufzunehmen und sie dann abzutransportieren. Diese Art der Selektion der Träger-Proteine könnte sicherstellen, dass die Elektronen an den richtigen Ort in der Zelle gelangen, an dem sie zur Erzeugung von Energie genutzt werden.
Originalveröffentlichung
Vorangegangene Forschungsarbeit:
Beteiligte Institute
- Max-Planck-Institut für Medizinische Forschung, Heidelberg
- Max-Planck-Institut für Biophysik, Frankfurt am Main
- Radboud Universität, Nijmegen, Niederlande
- Max-Planck-Institut für Marine Mikrobiologie, Bremen
Rückfragen bitte an:
Gruppenleiter
Forschungsgruppe Mikrobielle Physiologie
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
3126 |
|
Telefon: |

Gruppenleiter
Forschungsgruppe Strukturbiologie von Elementzyklen
Dr. Thomas Barends
Max-Planck-Institut für Medizinische Forschung
Jahnstraße 29
69120 Heidelberg
Telefon: +49 6221 486-508