- Presse
- Bunt markierte Zellen unter dem Mikr...
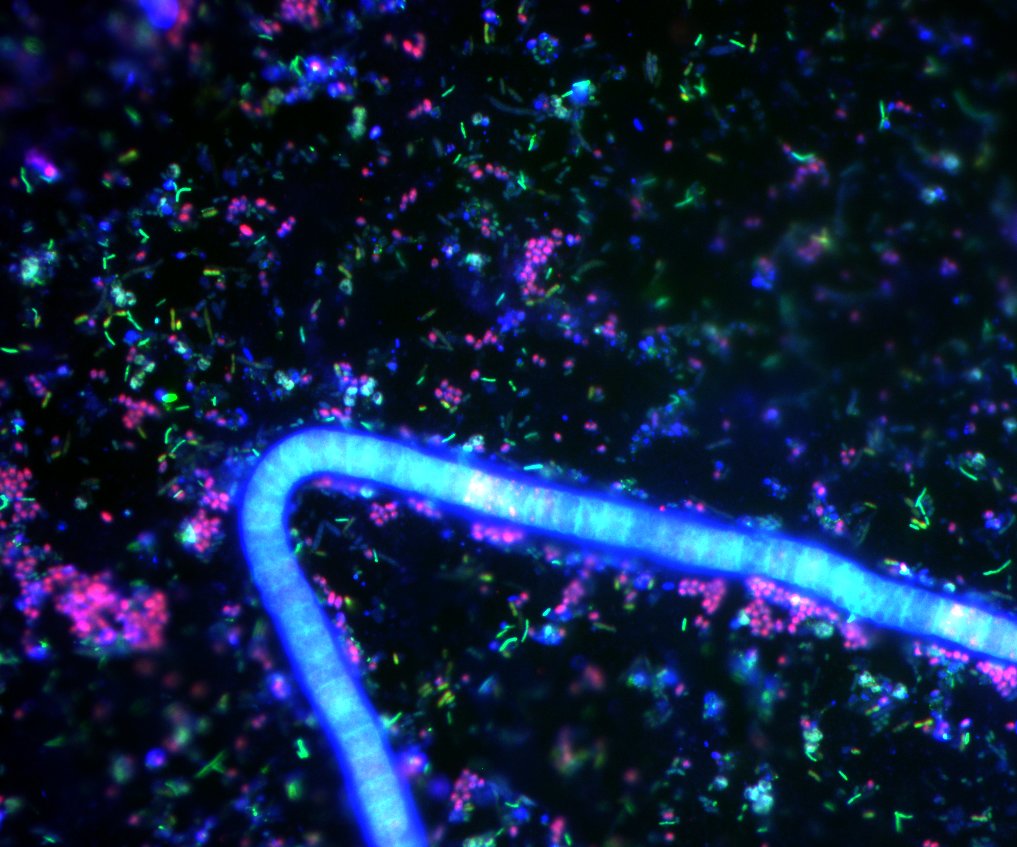
Bunt markierte Zellen unter dem Mikroskop
Was wächst denn da? Ob im Krankenhaus, in Lebensmitteln oder im Meer, Mikroorganismen sind allgegenwärtig. Sie nachzuweisen, zu unterscheiden und zu zählen gehört zu den Hauptaufgaben in der medizinischen Mikrobiologie und in den Umweltwissenschaften. Mit farbig markierten Sonden rücken die Forscher den Mikroben auf die Zellmembran und können unter dem Mikroskop prüfen, um welchen Organismus es sich handelt. Bremer Forscher haben jetzt ein neues bildgebendes Verfahren entwickelt, mit dem sich bis zu sieben verschiedene Arten gleichzeitig mit hoher Empfindlichkeit nachweisen lassen.
Fluoreszenz-in-situ-Hybridisierung (FISH), dieser etwas sperrige Name steht für ein Verfahren, mit dem sich Zellen anfärben lassen. In jeder Zelle gibt es eine große Anzahl von Molekülen der Erbsubstanz. Diese ist charakteristisch für jede Art von Lebewesen, fast so wie ein „Fingerabdruck“. Um diesen nachzuweisen, nehmen die Forscher künstlich hergestellte Sonden, die das passgenaue Gegenstück des „Fingerabdrucks“ darstellen und genau nur an diesen binden. Sollen die Zellen rot aufleuchten, hängen die Forscher der Sonde einen roten Farbstoff an.
Die Nadel im Heuhaufen finden
Diese Technik ist seit Jahren weltweit etabliert und erfolgreich. Leider stoßen die Forscher aber schnell an deren Grenzen, wenn es gilt, in einem Zellgemisch wenige einzelne Zellen nachzuweisen. Die Bremer Forscher haben nun diese Methode verfeinert und empfindlicher gemacht. Die klassische Analyse beruht darauf, nacheinander jeweils eine spezifische Sonde auf die Zellen zu geben und nachzuschauen, ob sie gebunden hat und ein Signal liefert. Es ist ein mühseliger Prozess und ein Balanceakt, denn ein Zuviel an Sonde führt dazu, dass die Sonde auch dort bindet, wo sie nicht passt und unerwünschtes Hintergrundrauschen verursacht. Man sieht den Wald vor lauter Bäumen nicht, oder wie Forscher es sagen würden: „Das Signal-Rausch-Verhältnis ist nicht optimal.“
Bessere Untersuchungsmethoden entwickeln
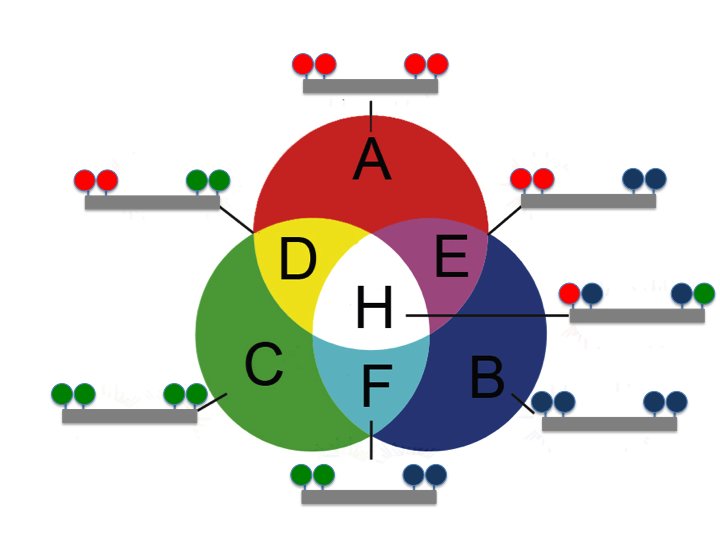
Diese Technik zu optimieren ist hohe Kunst. Die Bremer Forscher sind jetzt einen neuen Weg gegangen. Mario Schimak, Doktorand in der Abteilung Symbiose am Max-Planck-Institut für Marine Mikrobiologie in Bremen, sagt: „Wir haben uns überlegt, wie man die Methode grundlegend verbessern kann. Es stehen uns nur die drei Farben Rot, Grün und Blau zur Verfügung, also genau so viel wie beim TV-Signal.“
Schimaks Überlegung beruht darauf, die zur Verfügung stehenden Farbstoffmoleküle so in einer Sonde anzuordnen, dass neue Farbkombinationen wie beim TV-Signal entstehen und so viele verschiedene Sonden möglich werden. „Wir können mit nur drei verschiedenen Farbstoffmolekülen sieben farblich verschiedene Sonden darstellen.“ Sein Kollege Dr. Bernhard Fuchs ergänzt: „Wir haben die neue Methode an sehr schwierigen Proben getestet – beispielsweise an Proben aus tierischem Gewebe mit symbiontischen Bakterien. Und ja, sie funktioniert sogar da.“
Das Mikrobiom und das Wohlergehen der Welt
Inzwischen weiß man, dass ohne Mikroorganismen die Welt, wie wir sie kennen, nicht möglich wäre. Die Mikroben sorgen dafür, dass tote Lebewesen in ihre molekularen Bestandteile zersetzt werden. Aber auch in lebendigen Organismen erfüllen sie wichtige Aufgaben. Mario Schimak arbeitet in der Abteilung von Professorin Nicole Dubilier, die sich seit Jahren mit den Symbionten eines kleinen Wurms beschäftigt. Olavius algarvensis lebt im sandigen Sediment vor der Küste Elbas. Der Wurm überlässt seine Nahrungsaufnahme und die Verdauungsvorgänge mehreren verschiedenen Mikroorganismen, ein Darm oder Mund ist deshalb überflüssig. Die Techniken und Strategien, mit denen die Forscher im kleinen Wurm dessen Komplexität entschlüsselt haben, wollen sie jetzt auch auf andere Organismen anwenden. Professorin Nicole Dubilier sagt: „Wir wollen in Umweltproben oder in Geweben und Organen von Tieren die mikrobielle Zusammensetzung studieren. Dabei geht es uns um das Mikrobiom, also der Gesamtheit der Mikroorganismen. Olavius algarvensis ist nur ein Beispiel. So trägt jeder Mensch ungefähr ein Kilogramm Mikroorganismen mit sich, das ist das Zehnfache der Anzahl an Körperzellen. Diese Mikroorganismen sind lebensnotwendig und manche Krankheitsbilder weisen auf ein gestörtes Mikrobiom hin. Ich denke, in Mikrobiom-Studien liegt die Zukunft. Nicht nur im Umweltbereich, sondern auch in der Medizin.“
Mario P. Schimak, Manuel Kleiner, Silke Wetzel, Manuel Liebeke, Nicole Dubilier, Bernhard M. Fuchs. 2016. MiL-FISH: Multi-labelled oligonucleotides for fluorescence in situ hybridisation improve visualization of bacterial cells. Appl Environ Microbiol 82:1, 62-70 , doi:10.1128/AEM.02776-15
Beteiligte Institute
Max-Planck-Institut für Marine Mikrobiologie, Bremen
Energy Bioengineering and Geomicrobiology Research Group, University of Calgary, Calgary, Alberta, Canada.
Mario Schimak
Max-Planck-Institut für Marine Mikrobiologie, Celsiusstr. 1
D-28359 Bremen, Telefon: 0421 2028 – 907, mschimak(at)mpi-bremen.de
PD Dr. Bernhard Fuchs
Max-Planck-Institut für Marine Mikrobiologie, Celsiusstr. 1
D-28359 Bremen, Telefon: 0421 2028 – 935, bfuchs(at)mpi-bremen.de
oder an die Pressesprecher des MPIMM
Dr. Manfred Schlösser
Telefon: 0421 2028 – 704, mschloes(at)mpi-bremen.de
Dr. Fanni Aspetsberger
Telefon: 0421 2028 – 645, faspetsb(at)mpi-bremen.de