- Presse
- Vom Rosenduft zu Nylon und den Kunst...
Vom Rosenduft zu Nylon und den Kunststoffen
Vom Rosenduft zu Nylon und den Kunststoffen
Enzym für die Kunststoffproduktion aus nachwachsenden Rohstoffen
Betörende Düfte, nüchterne Fakten: von Pflanzen ausgehende Düfte sind fast immer Monoterpene und Monoterpenalkohole, die ätherischen Öle der Pflanzen sind natürliche Kohlenwasserstoffverbindungen. So ist Geraniol der verlockend duftende Alkohol der Rosen. Forscher des Max-Planck-Instituts für Marine Mikrobiologie in Bremen haben schon 2010 die Entdeckung eines Enzyms publiziert, welches das Rosen-duftende Geraniol in das Koriander-duftende Coriandrol ((S)-Linalool) und weiter in das Hopfen-duftende Myrcen umsetzt. Dieses Enzym, die Linalool Dehydratase/Isomerase, ist jedoch auch in der Lage, aus natürlichen Rohstoffen, z. B. Fermentationsprodukten, Butadien zu bilden, eine zentrale Verbindung bei der Herstellung von Kunststoffen. Jetzt konnten die Forscher die genaue räumliche Struktur des Enzyms und die Bindung von Geraniol und Myrcen im Enzym aufklären, ein wichtiger Meilenstein auf dem Weg von der Erdölchemie hin zur Energie-ökonomischen Nutzung natürlicher Rohstoffe.
Butadien und Isopren: wichtige Zwischenstoffe in der Kunststoffproduktion
Butadien und Isopren sind Zwischenprodukte in der Herstellung von Nylon, hochschmelzenden Kunststoffen (ABS-Polymere) und Gummiprodukten. Bislang wird Butadien aufwendig durch Spaltung von Erdöl erzeugt. Deshalb hat die chemische Industrie großes Interesse an Energie-ökonomischen Alternativen zur Butadien-Synthese.
Jährlich werden unter erheblichem Energieverbrauch über 10 Millionen Tonnen Butadien und Isopren aus fossilen Brennstoffen erzeugt, ein Markt von über 15 Milliarden Euro. Die hohen Ölpreise und steigender Bedarf lösten vor einigen Jahren eine intensive Suche nach alternativen Herstellungsmethoden aus. Für die Umstellung auf nachwachsende Rohstoffe als Ausgangsmaterial und für die Energie-arme Herstellungsweise werden Biokatalysatoren benötigt. Die katalytischen Fähigkeiten der Linalool Dehydratase/Isomerase eignen sich ideal für diese Aufgabe. Aufbauend auf der Entdeckung des Enzyms durch Bremer Forscher im Jahre 2010 liegen inzwischen zahlreiche Patentanträge und Patente zur Nutzung dieses Enzyms bei der Herstellung von Butadien und Isopren vor.
Substratbindung am Enzym sichtbar gemacht
Um das Enzym effektiv in der Industrie einsetzen zu können, muss man dessen innere Architektur kennen und wissen, wie und wo die eigentliche Umsetzung stattfindet. Jetzt ist es Sina Weidenweber und Ulrich Ermler vom Max-Planck-Institut für Biophysik in Frankfurt und Robert Marmulla und Jens Harder vom Max-Planck-Institut für marine Mikrobiologie in Bremen gelungen, die molekulare Struktur des Enzyms aufzuklären. Das Enzym ist aus fünf identischen Untereinheiten zusammengesetzt und hat eine einzigartige Bindungsstelle für die Monoterpenalkohole. „Es war in den letzten Jahren sehr erfreulich, die schnelle Nutzung unserer Ergebnisse aus der Grundlagenforschung in der angewandten Industrieforschung zu sehen. Die Linalool Dehydratase/Isomerase-Struktur und die damit verbundene genaue Kenntnis der Geraniol- und Myrcen-Bindungstellen und des Katalysemechanismus werden es den industriellen Firmen jetzt ermöglichen, dieses eigentlich Monoterpene abbauende Enzym für die biotechnologische Produktion von Butadien und Isopren zu optimieren.“, sagt Jens Harder.
Originalveröffentlichung
Weidenweber, Sina; Marmulla, Robert; Ermler, Ulrich; Harder, Jens
X-ray structure of linalool dehydratase/isomerase from Castellaniella defragrans reveals enzymatic alkene synthesis.
FEBS Letters 2016, doi 10.1002/1873-3468.12165
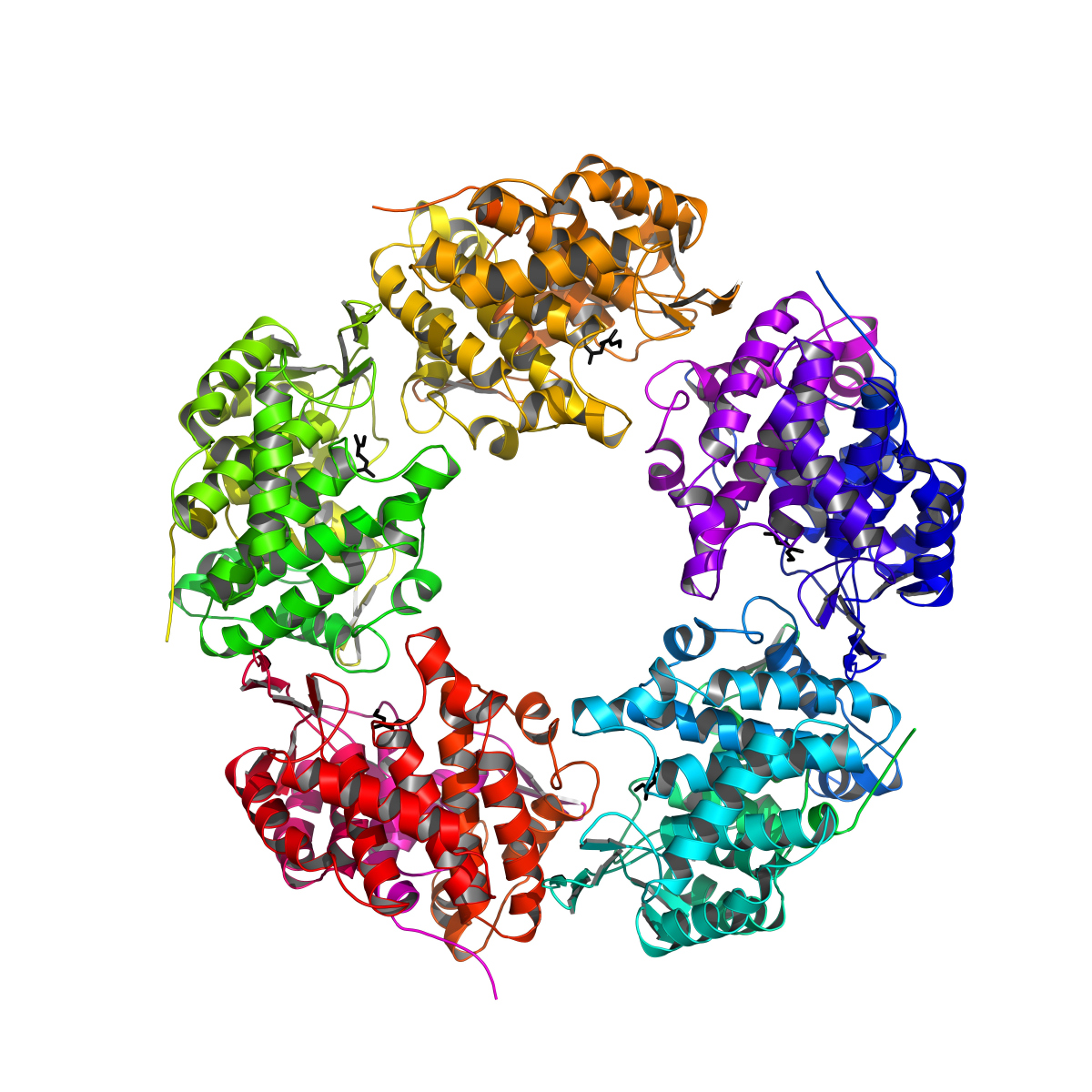
(Computergraphik, Sina Weidenweber und Ulrich Ermler, Max-Planck-Institut für Biophysik, Frankfurt)
Prof. Dr. Jens Harder
Max-Planck-Institut für Marine Mikrobiologie, Bremen
Telefon: 0421 2028-750
E-Mail: [Bitte aktivieren Sie Javascript]
PD Dr. Ulrich Ermler
Max-Planck-Institut für Biophysik, Frankfurt
Telephon: 069 6303 1054
E-mail: [Bitte aktivieren Sie Javascript]
Pressekontakt:
Max-Planck-Institut für Marine Mikrobiologie:
Dr. Manfred Schlösser
Telefon: 0421 2028 - 704
Fax:0421 2028 - 790
E-Mail: [Bitte aktivieren Sie Javascript]
Dr. Fanni Aspetsberger
Telefon: 0421 2028 - 947
E-Mail:presse@mpi-bremen.de
Beteiligte Institute
Max-Planck-Institut für Marine Mikrobiologie
Max-Planck-Institut für Biophysik
