Seitenpfad:
- Presse
- Pressemeldungen 2014
- 27.01.2014 Rätselhaftes Methan
27.01.2014 Rätselhaftes Methan
Rätselhaftes Methan
Nature Geoscience Studie enthüllt
biogeochemischen Mechanismus im Meeresboden
In einer Studie, die gestern vorab online im Fachmagazin Nature Geoscience erschien, sind Bremer Meeresforscher gemeinsam mit einem US-Kollegen einem bislang ungelösten Rätsel im Meeresboden auf die Spur gekommen. Das Team weist nach, warum Methan in manchen Schichten des Meeresbodens eine ungewöhnliche Isotopensignatur zeigt. Der jetzt entdeckte biogeochemische Vorgang könnte auch für andere Umsatzprozesse im Meer von Bedeutung sein.
Als Bremer Wissenschaftler des MARUM und des Max-Planck-Instituts für Marine Mikrobiologie kürzlich Isotopengehalte von Methan aus weltweiten Meeresablagerungen eingehender untersuchten, stießen sie immer wieder auf ein seltsames Phänomen: Dort, wo Mikroorganismen mit Hilfe von Sulfat im Meeresboden Methan verbrauchen, blieb im restlichen Methan nicht wie erwartet schwerer Kohlenstoff-13 zurück, sondern leichter Kohlenstoff-12. „Dieser Befund wurde bis dato als klares Zeichen für eine biologische Methanbildung interpretiert“, erklärt Marcos Yoshinaga, Erstautor der Nature Geoscience-Studie, der bis vor kurzem am MARUM tätig war und sich aktuell an der Universität von São Paulo aufhält. „Allerdings konnten wir uns keinen biogeochemischen Prozess vorstellen, der dieses bei aktivem Methanverbrauch unterstützen könnte“, ergänzt sein Kollege Marcus Elvert vom MARUM. Als Regel galt bislang nämlich, dass beim Methanverbrauch durch Oxidation vorrangig das leichtere Isotop Kohlenstoff-12 umgesetzt wird und sich somit das schwerere Kohlenstoff-13 im zurückbleibenden Methan im Meeresboden anreichert.
Um ihre Befunde zu überprüfen, stellte das Forscherteam die im Meeresboden ablaufenden Prozesse im Laborexperiment nach. „Die mikrobiologische Sammlung des Max-Planck-Instituts mit ihren weltweit einmaligen Kulturen methanoxidierender Mikroorganismen bietet die Möglichkeit, solche besonderen Lebensbedingungen genau nachzubilden“, sagt Max-Planck-Mikrobiologe Thomas Holler. Und tatsächlich: Wenn den Mikroorganismen nur sehr wenig Sulfat zur Verfügung stand, blieb in den Laborkulturen, wie auch im Meeresboden beobachtet, Methan zurück, dass mit dem leichten Isotop Kohlenstoff-12 angereichert war.
Zum Hintergrund: Methan hat zwei Facetten: Das Gas, das aus Kohlenstoff- und Wasserstoff besteht, dient einerseits als Energieträger und ist andererseits ein starkes Treibhausgas. Geschätzt wird, dass im Ozeangrund zwischen 500 und 10.000 Milliarden Tonnen gespeichert sind. Dass indes weniger als zwei Prozent des weltweit in die Atmosphäre freigesetzten Methans aus dem Meeresboden stammen, ist Mikroorganismen zu verdanken, die in sauerstofffreien Zonen unter Verwendung von Sulfat Methan umsetzen. „Wir haben diesen Prozess untersucht, indem wir die Signaturen stabiler Isotope des Methans weltweit verglichen haben. Dabei erkannten wir ein ungewöhnliches Isotopenmuster, für das wir keine schlüssige Erklärung fanden", sagt John Pohlman vom US-amerikanischen Geological Survey. Stabile Isotope eines Elements, wie etwa Kohlenstoff, enthalten gleich viele Protonen, unterscheiden sich jedoch in Bezug auf ihre Neutronenzahl und damit ihre Masse. Zwar zeigen sie keine Unterschiede im Verhalten bei chemischen Reaktionen, wohl aber hinsichtlich ihrer Reaktionsgeschwindigkeiten, so dass bei biogeochemischen Prozessen in der Regel das leichte Isotop Kohlenstoff-12 bevorzugt wird, während das schwere Isotop Kohlenstoff-13 übrig bleibt.
Naturgemäß wollten die Bremer Forscher auch die Frage beantworten, warum sich bei niedrigen Sulfatgehalten leichter Kohlenstoff-12 im Methan anreichert. Als Erklärung führen sie an, dass die biogeochemische Reaktion nahe am energetischen Limit für die Existenz von Leben abläuft. Unter solchen Bedingungen befinden sich alle beteiligten Stoffe bei der Reaktion nahezu im Gleichgewicht. „Aufgrund dessen landet das leichte Kohlenstoff-12 wieder im Methan“, erklärt Gunter Wegener vom Max-Planck-Institut. „Diesen Befund konnten wir mit Hilfe unserer biogeochemischen Modelle untermauern und damit ein global vorhandenes Phänomen erklären“, bestätigt Tobias Goldhammer vom MARUM.
„Unsere Studie ermöglicht neue Einblicke, wie bestimmte Archaeen, die unter großem Energiemangel tief im Meeresboden leben, ihre Stoffwechselvorgänge an diese Bedingungen anpassen. Damit liefert sie Antworten auf eine der zentralen Fragen unseres Projekts“, fügt Kai-Uwe Hinrichs hinzu, der zugleich Leiter des Projekts DARCLIFE ist, das vom Europäischen Forschungsrat ERC gefördert wird. In einem nächsten Schritt wollen die Wissenschaftler klären, ob auch andere wichtige biogeochemischen Prozesse im Meeresboden, wie etwa die Methanbildung selbst, durch solche Reaktionen beeinflusst werden.
Nature Geoscience Studie enthüllt
biogeochemischen Mechanismus im Meeresboden
In einer Studie, die gestern vorab online im Fachmagazin Nature Geoscience erschien, sind Bremer Meeresforscher gemeinsam mit einem US-Kollegen einem bislang ungelösten Rätsel im Meeresboden auf die Spur gekommen. Das Team weist nach, warum Methan in manchen Schichten des Meeresbodens eine ungewöhnliche Isotopensignatur zeigt. Der jetzt entdeckte biogeochemische Vorgang könnte auch für andere Umsatzprozesse im Meer von Bedeutung sein.
Als Bremer Wissenschaftler des MARUM und des Max-Planck-Instituts für Marine Mikrobiologie kürzlich Isotopengehalte von Methan aus weltweiten Meeresablagerungen eingehender untersuchten, stießen sie immer wieder auf ein seltsames Phänomen: Dort, wo Mikroorganismen mit Hilfe von Sulfat im Meeresboden Methan verbrauchen, blieb im restlichen Methan nicht wie erwartet schwerer Kohlenstoff-13 zurück, sondern leichter Kohlenstoff-12. „Dieser Befund wurde bis dato als klares Zeichen für eine biologische Methanbildung interpretiert“, erklärt Marcos Yoshinaga, Erstautor der Nature Geoscience-Studie, der bis vor kurzem am MARUM tätig war und sich aktuell an der Universität von São Paulo aufhält. „Allerdings konnten wir uns keinen biogeochemischen Prozess vorstellen, der dieses bei aktivem Methanverbrauch unterstützen könnte“, ergänzt sein Kollege Marcus Elvert vom MARUM. Als Regel galt bislang nämlich, dass beim Methanverbrauch durch Oxidation vorrangig das leichtere Isotop Kohlenstoff-12 umgesetzt wird und sich somit das schwerere Kohlenstoff-13 im zurückbleibenden Methan im Meeresboden anreichert.
Um ihre Befunde zu überprüfen, stellte das Forscherteam die im Meeresboden ablaufenden Prozesse im Laborexperiment nach. „Die mikrobiologische Sammlung des Max-Planck-Instituts mit ihren weltweit einmaligen Kulturen methanoxidierender Mikroorganismen bietet die Möglichkeit, solche besonderen Lebensbedingungen genau nachzubilden“, sagt Max-Planck-Mikrobiologe Thomas Holler. Und tatsächlich: Wenn den Mikroorganismen nur sehr wenig Sulfat zur Verfügung stand, blieb in den Laborkulturen, wie auch im Meeresboden beobachtet, Methan zurück, dass mit dem leichten Isotop Kohlenstoff-12 angereichert war.
Zum Hintergrund: Methan hat zwei Facetten: Das Gas, das aus Kohlenstoff- und Wasserstoff besteht, dient einerseits als Energieträger und ist andererseits ein starkes Treibhausgas. Geschätzt wird, dass im Ozeangrund zwischen 500 und 10.000 Milliarden Tonnen gespeichert sind. Dass indes weniger als zwei Prozent des weltweit in die Atmosphäre freigesetzten Methans aus dem Meeresboden stammen, ist Mikroorganismen zu verdanken, die in sauerstofffreien Zonen unter Verwendung von Sulfat Methan umsetzen. „Wir haben diesen Prozess untersucht, indem wir die Signaturen stabiler Isotope des Methans weltweit verglichen haben. Dabei erkannten wir ein ungewöhnliches Isotopenmuster, für das wir keine schlüssige Erklärung fanden", sagt John Pohlman vom US-amerikanischen Geological Survey. Stabile Isotope eines Elements, wie etwa Kohlenstoff, enthalten gleich viele Protonen, unterscheiden sich jedoch in Bezug auf ihre Neutronenzahl und damit ihre Masse. Zwar zeigen sie keine Unterschiede im Verhalten bei chemischen Reaktionen, wohl aber hinsichtlich ihrer Reaktionsgeschwindigkeiten, so dass bei biogeochemischen Prozessen in der Regel das leichte Isotop Kohlenstoff-12 bevorzugt wird, während das schwere Isotop Kohlenstoff-13 übrig bleibt.
Naturgemäß wollten die Bremer Forscher auch die Frage beantworten, warum sich bei niedrigen Sulfatgehalten leichter Kohlenstoff-12 im Methan anreichert. Als Erklärung führen sie an, dass die biogeochemische Reaktion nahe am energetischen Limit für die Existenz von Leben abläuft. Unter solchen Bedingungen befinden sich alle beteiligten Stoffe bei der Reaktion nahezu im Gleichgewicht. „Aufgrund dessen landet das leichte Kohlenstoff-12 wieder im Methan“, erklärt Gunter Wegener vom Max-Planck-Institut. „Diesen Befund konnten wir mit Hilfe unserer biogeochemischen Modelle untermauern und damit ein global vorhandenes Phänomen erklären“, bestätigt Tobias Goldhammer vom MARUM.
„Unsere Studie ermöglicht neue Einblicke, wie bestimmte Archaeen, die unter großem Energiemangel tief im Meeresboden leben, ihre Stoffwechselvorgänge an diese Bedingungen anpassen. Damit liefert sie Antworten auf eine der zentralen Fragen unseres Projekts“, fügt Kai-Uwe Hinrichs hinzu, der zugleich Leiter des Projekts DARCLIFE ist, das vom Europäischen Forschungsrat ERC gefördert wird. In einem nächsten Schritt wollen die Wissenschaftler klären, ob auch andere wichtige biogeochemischen Prozesse im Meeresboden, wie etwa die Methanbildung selbst, durch solche Reaktionen beeinflusst werden.
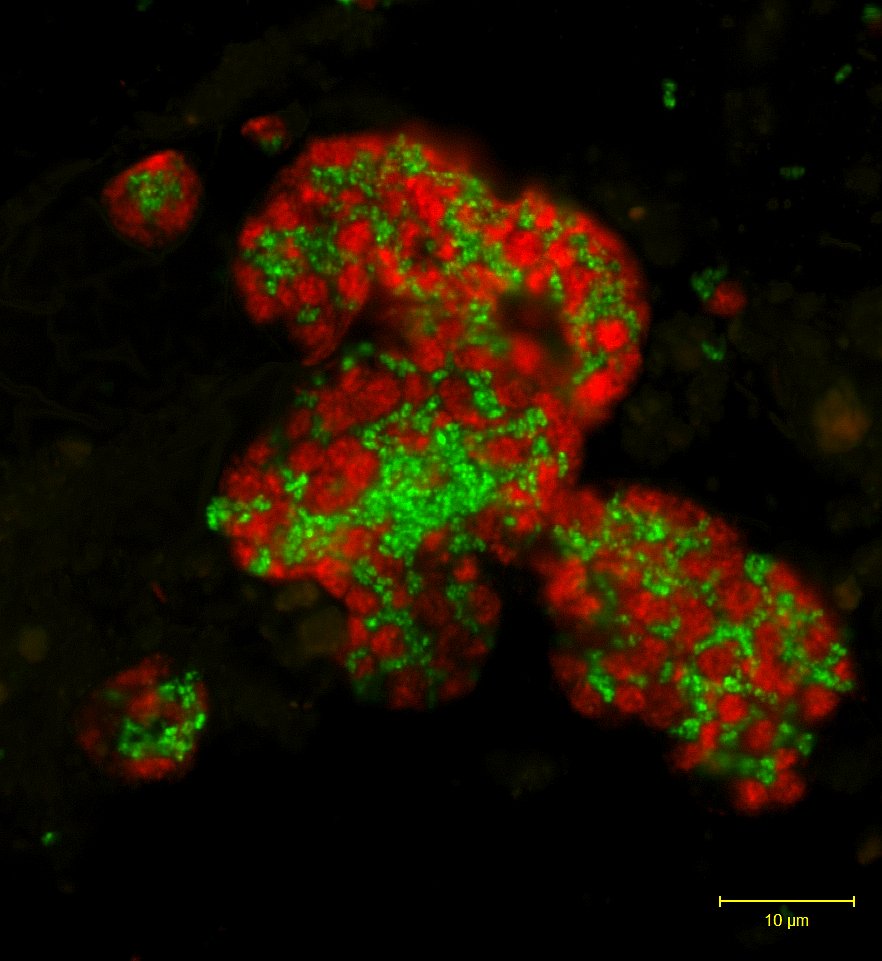
Ein Blick durch das Fluoreszenzmikroskop auf die für die Oxidation von Methan verantwortlichen mikrobiellen Konsortien. Die anaeroben methanoxidierenden (ANME) Archeen (rot) bilden große Aggregate mit Partnerbakterien (grün).
(Zellspezifische Färbung durch Fluoreszenz-In Situ Hybridisierung). Quelle MPIMM
(Zellspezifische Färbung durch Fluoreszenz-In Situ Hybridisierung). Quelle MPIMM
Rückfragen an
Dr. Gunter Wegener
MPI für Marine Mikrobiologie, Celsiusstr. 1, D-28359 Bremen
Telefon: 0421 2028 - 867
E-Mail:gwegener@mpi-bremen.de
oder an den Pressesprecher
Dr. Manfred Schlösser
MPI für Marine Mikrobiologie, Celsiusstr. 1, D-28359 Bremen
Telefon: 0421 2028 - 704
E-Mail: [Bitte aktivieren Sie Javascript]
Publikation:
Marcos Y. Yoshinaga, Thomas Holler, Tobias Goldhammer, Gunter Wegener, John W. Pohlman, Benjamin Brunner, Marcel M. M. Kuypers, Kai-Uwe Hinrichs, Marcus Elvert: Carbon isotope equilibration during sulphate-limited anaerobic oxidation of methane; in Nature Geoscience Advanced Online Publication.
Siehe: http://www.nature.com/ngeo/journal/vaop/ncurrent/full/ngeo2069.html
Dr. Gunter Wegener
MPI für Marine Mikrobiologie, Celsiusstr. 1, D-28359 Bremen
Telefon: 0421 2028 - 867
E-Mail:gwegener@mpi-bremen.de
oder an den Pressesprecher
Dr. Manfred Schlösser
MPI für Marine Mikrobiologie, Celsiusstr. 1, D-28359 Bremen
Telefon: 0421 2028 - 704
E-Mail: [Bitte aktivieren Sie Javascript]
Publikation:
Marcos Y. Yoshinaga, Thomas Holler, Tobias Goldhammer, Gunter Wegener, John W. Pohlman, Benjamin Brunner, Marcel M. M. Kuypers, Kai-Uwe Hinrichs, Marcus Elvert: Carbon isotope equilibration during sulphate-limited anaerobic oxidation of methane; in Nature Geoscience Advanced Online Publication.
Siehe: http://www.nature.com/ngeo/journal/vaop/ncurrent/full/ngeo2069.html